ТЕОРИЯ СТЕКЛООБРАЗНОГО СОСТОЯНИЯ
И СТРОЕНИЯ СТЕКЛА
Теория строения
стекла
А.И.БОЛУТЕНКО
E-mail: bolutenko@mail.ru Физика стекла Главная
АННОТАЦИЯ
Разработана теория стеклообразования и
строения стекла. Стекло – такое сочетание или искусственная смесь атомов,
образующих закономерно построенную стеклообразную структуру в соответствии с их
зарядами, наиболее стабильную в естественных земных условиях, характеризующуюся
дискретным набором различных по силе химических связей, определяющих природу
стеклообразного состояния, и представляющее упорядоченную систему, обладающее
переменной структурой и приведенным дальним порядком. Стеклообразное состояние
является наиболее общей формой существования материи в виде твёрдых тел,
кристаллическое состояние – частный случай стеклообразного.
Предлагаемая теория объясняет ряд
признаков, физико-химических свойств и явлений в стеклообразном состоянии. На
основе теории стеклообразного состояния можно с единых позиций объяснить
экспериментальные данные по исследованию всех физико-химических свойств стёкол.
1. ПОНЯТИЕ
«СТЕКЛО»
Несмотря на многовековую историю стекла
как материала вопрос о его строении является нерешённым до сих пор. На фоне
прогресса в развитии материаловедения и физики твёрдого тела кажущаяся простота
вопроса, тем не менее, выдвигает теорию неупорядоченных систем к важнейшим
нерешённым проблемам физики.
Классическим представителем неупорядоченных
систем является стекло. В последние годы работ, в которых делались бы попытки
построения моделей строения стекла, почти не публикуется. До сих пор понятие
«стекло» является не установившимся, к этому вопросу периодически приходится
возвращаться [1]. Если ранее делались попытки построения общей теории стекла,
то в настоящее время твёрдо признано, что структуры стекла вообще не
существует, каждое стекло имеет своё строение, отличающееся типом связи,
характером структуры, микрогетерогенностью, ближним порядком и другими
структурными особенностями [2]. Признание предположения о невозможности
построения общей теории стекла как раз и привело к отсутствию работ в этой
области. Положение о том, что каждое стекло имеет своё строение, не вызывает
сомнения. Однако, должны существовать принципы построения стеклообразных
некристаллических структур, которые являются общими для всех стёкол.
2. ПЕРЕОХЛАЖДЕНИЕ
Обычно стёкла по существующим
представлениям считаются переохлаждёнными жидкостями, в связи с чем они
находятся в метастабильном состоянии. Хотя большинство составов стёкол при
термообработке кристаллизуется, имеются стёкла с низкой кристаллизационной
способностью и такие стёкла, кристаллизация которых вообще невозможна.
В работе [3] показано, что стекло не
является переохлаждённой жидкостью, а представляет самостоятельную
стеклообразную структуру. Структура стекла состоит из такого набора атомов,
который в силу распределения их зарядов не может составить упорядоченного
кристаллического соединения. Широкий спектр набора химических связей в
структуре стекла по прочности при характеристике каждого уровня прочности
собственной температурой ликвидуса приводит к плавному переходу от жидкости к
твёрдому телу, создавая иллюзию переохлаждения
(Рис. 1).
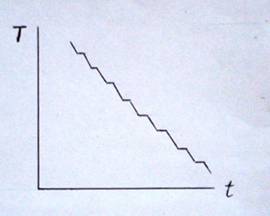
Рис.
1. Зависимость температуры расплава стекла от времени
Однако, при термообработке большинство
стёкол кристаллизуется. Возникает противоречие – с одной стороны стёклам не
присуще переохлаждение и они не являются жидкостями, а с другой –
переохлаждение всё же есть. Переохлаждение в этих стёклах происходит не по
всему объёму, а является вторичным и охватывает лишь некоторые области [4]. В
таких стёклах при медленном охлаждении возможно получение кристаллических
областей. Эти стёкла имеют такой набор атомов, который при их
электростатическом взаимодействии образует устойчивую стеклообразную структуру,
но при этом находятся атомы, которые не могут встраиваться в общую структуру и
образуют правильную кристаллическую решётку. Фактически такие стёкла не
являются истинными стёклами, а представляют собой композит «стекло – кристалл».
В случае, если в расплаве нет условий для образования кристаллов, стекло
образуется всегда при любых режимах охлаждения расплава. Причём, такие стёкла
не кристаллизуются при термообработке.
Таким образом, переохлаждение возможно при
стеклообразовании, но не является обязательным для перехода расплава в
стеклообразное состояние. Ряд стёкол при научных исследованиях удаётся получить
при быстром охлаждении за счёт переохлаждения отдельных микрообластей, и
поэтому переохлаждение имеет некоторое значение при стеклообразовании. Однако,
вторичное переохлаждение в некоторых микрообластях стеклообразной структуры
нельзя отождествлять с переохлаждением, которое считается путём получения
стеклообразного состояния вещества. Визуальное определение областей
стеклообразования при исследовании стеклообразующих систем может ввести в
заблуждение. Промышленные составы стёкол являются истинными стеклами и не
кристаллизуются при термообработке. К примеру, длительность отжига
астрономических дисков диаметром 1,5-2,0
м достигает 3-6
месяцев [5].
3. СТЕКЛО –
СТАБИЛЬНАЯ ФОРМА ВЕЩЕСТВА
Из представлений о переохлаждении расплава
при стеклообразовании вытекает метастабильность стекла. В настоящее время
стекло считается неравновесной системой. Устойчивость неравновесного состояния
стекла при низких температурах объясняется недостаточностью энергии теплового
движения для преодоления высоких потенциальных барьеров. В работе [6] показано,
что стекло является стабильной формой существования твёрдых тел. Набор атомов,
заданный химическим составом стекла, может образовывать систему с наименьшей
энергией, то есть образуется стеклообразная структура с минимальным
потенциалом. Наряду со стабильной структурой в стёклах при соответствующем
химическом составе могут образовываться нестабильные участки структуры в
результате вторичного переохлаждения или даже участки с правильной
кристаллической решёткой. Предложен целый ряд гипотез строения стекла [4].
Однако, при построении этих гипотез всегда считалось, что стекло представляет
собой переохлаждённую метастабильную жидкость. В работах [7, 8] показано, что
при построении модели стекла нельзя проводить аналогию со структурой жидкости,
так как стекло является твёрдым телом. Таким образом, в отличие от
существующего подхода нами при построении теории строения стекла в основу
положены иные принципы, а именно: стекло является не метастабильной
переохлаждённой жидкостью, а стабильным твёрдым телом.
4. ПРОЦЕСС
СТЕКЛООБРАЗОВАНИЯ
Обычно считается, что значительное
понижение вязкости расплава при понижении температуры приводит к фиксации
неравновесной высокотемпературной структуры жидкости [9]. Это происходит
потому, что при высоких вязкостях расплава порядка 1013 пуаз
структура не успевает следовать за изменением температуры. Дальнейшее
охлаждение такой замороженной структуры приводит к закреплению структуры
жидкости, приобретённой в состоянии высокой вязкости, что приводит к
образованию стекла [10].
Почему стекло имеет структуру жидкости, а
не жидкость структуру стекла? Если рассматривать образование кристаллов из
расплава, то какую же структуру имеет кристалл? Несомненно, что жидкость
отражает структуру твёрдого тела, из которой оно образуется. Но таким же
образом и твёрдое тело указывает на структуру расплава. Стёкла обычно
образуются только из высоковязких расплавов. Почему же для стеклообразования
необходим вязкий расплав в отличие от расплавов, образующих кристаллы?
Очевидно, что уже в расплаве заложена структура будущего твёрдого тела. Поэтому
все расплавы нельзя считать идентичными. Стёкла образуются из расплавов не
благодаря их высокой вязкости и фиксации высокотемпературной структуры, а,
наоборот, вязкость расплава большая в связи с тем, что это расплав
стеклообразного вещества.
Рассмотрим, каким образом происходит
стеклообразование. Наиболее сложным, и в то же время основополагающим в вопросе
понимания образования стёкол из кристаллических веществ, является переход в
стеклообразное состояние чистых окислов, то есть получение однокомпонентных
стёкол. Очевидно, что образование стекла из кристаллического вещества связано с
перестройкой структуры – перемещениями атомов в кристаллической решётке и
образованием структуры стекла [11, 12].
Проследим процесс образования кварцевого
стекла из кремнезёма. Возможность получения кварцевого стекла указывает на
способность химических связей кремний – кислород в кремнекислородных тетраэдрах
кварца изменять свои параметры. Такая способность целого ряда окислов к
изменению параметров кристаллической решётки при расплавлении как раз
определяет возможность технического получения стекла.
Весьма важным в вопросе понимания
стеклообразования является факт отсутствия природных стёкол в первичных
образованиях земной коры. Следовательно, при формировании земной коры не было
условий, позволяющих кремнезёму и другим стеклообразующим окислам перейти в
стекловидное состояние.
При расплавлении кремнезёма атомы
кислорода в кремнекислородных тетраэдрах занимают новые положения, которые
соответствуют минимумам энергии в данном состоянии. При охлаждении расплава
кремнезёма атомы уже не могут образовывать первоначальную кристаллическую
структуру и затвердевают в виде стекла. Это указывает на отсутствие внешних
условий при охлаждении, способствующих образованию правильной кристаллической
решётки. Низкое давление ведёт к снижению плотности упаковки системы, и она
переходит в стеклообразное состояние.
Переход ряда окислов после расплавления
при атмосферном давлении в стеклообразное состояние указывает на их
нестабильность в данных условиях. Стабильными веществами при давлении 1
атмосфера в условиях гравитационного поля Земли можно считать лишь такие,
которые при затвердевании из расплава образуют свою первоначальную структуру.
Кристаллические вещества, метастабильные в
обычных условиях, представляют собой класс стеклообразователей.
Многокомпонентные стёкла на основе стеклообразователей можно получать путём
введения в их состав стабильных окислов. Это возможно благодаря тому, что
стеклообразователь вносит в структуру материала довольно большое количество
анионов. В этом случае в структурной сетке имеются свободные места между
анионами, где могут становиться катионы других окислов. Эти окислы, которые
принято называть модификаторами, вносят свой кислород для образования сетки
стекла. В принципе, в построении каркаса стеклообразного вещества участвуют
абсолютно все элементы, входящие в оксидные стёкла. Однако, стеклообразователь
необходим для построения некристаллической структуры. Модифицирующие окислы,
введенные в некристаллический каркас, благодаря взаимодействию
электростатического поля атомов, также изменяют параметры своих атомных связей,
приспосабливаясь к мотиву структурной сетки стеклообразователя. Анионный каркас
стекла строится из кислородов всех элементов на базе
окислов-стеклообразователей. В промежутках между кислородами находятся катионы,
расположение которых определяется динамическим равновесием всех атомов в
структуре стекла.
Стеклообразователями обычно являются
окислы элементов с валентностью более трёх, способные образовывать кислородные
соединения. Однако, переходить из расплава в стёкла могут и элементы с более
низкой валентностью, кристаллические кислородные соединения которых нестабильны
в обычных условиях.
Образование из расплава при охлаждении
самой стабильной структуры характеризует упорядоченность стекла. Структура
стекла образуется благодаря взаимодействию входящих в его состав атомов, то
есть она определяется тем электростатическим полем, которое имеется в стекле.
Стекло – не переохлаждённая жидкость, а
структура, состоящая из такого набора атомов, который не может составить
упорядоченного кристаллического соединения в силу распределения зарядов атомов.
Положение атомов компонентов, входящих в стекло, характеризуется их
электрическими зарядами. Именно электрический заряд атомов расставляет их в
определённом порядке. Все ионы в структуре стекла находятся в узлах равновесия.
Это есть узлы стеклообразной решётки. Располагаться в междоузлиях ионы не
могут, так как для ионов в структуре таковых не существует – где в данный
момент находится ион, там находится и узел.
Любой переход ионов в новое место за счёт
диффузии или при электропроводности ведёт к немедленной реакции структуры,
которая может перейти в напряжённое состояние вплоть до перестройки в зоне её
возмущения. На новом местонахождении каждого иона образуются новые связи.
Стеклообразная структура, таким образом, постоянно находится в динамическом
равновесии.
При некоторой температуре в массе вещества
имеется равновесие атомов согласно их заряда, и фактически нельзя сказать, что
данному аниону принадлежит именно этот катион. Любой ион уравновешивает своим
электрическим полем все заряды, координирующие с ним. При этом основная часть
заряда идёт на взаимодействие с первой координирующей сферой, на следующие
сферы воздействие заряда очень резко уменьшается. Одинаковые заряды в различных
катионах неравнозначны. Имеет значение ионный радиус катиона и количество экранирующих
его элементов.
Есть ли в стекле химические соединения? В
нормальных условиях для кристаллических веществ химическое соединение всегда
определённо. Химическое соединение – это возможность взаимного сосуществования
атомов, способных прочно удерживаться друг возле друга. С этой точки зрения в
стекле есть химические соединения, но они неопределённого состава.
Что же удерживает все атомы стекла в
едином блоке? Такой силой является коллективная химическая связь. Силами,
приводящими к монолиту, к единой большой «молекуле» являются силы
неуравновешивания электрического заряда в каждом элементарном объёме стекла.
Это неуравновешивание происходит в связи с асимметрией структуры из-за
соответствующего набора атомов. Различия по силе химической связи в твёрдом
теле как раз и определяют природу стеклообразного состояния.
В связи с невозможностью точного
сбалансирования электрических зарядов ионов в стёклах, как и в кристаллических
телах, имеются несовершенства структуры. Однако, стёкла являются твёрдыми
телами не со случайной, а с постоянной структурой, соответствующей
определённому химическому составу. Получение воспроизводимости
экспериментальных данных по плотности и другим физико-химическим свойствам
указывает на закономерности в образовании структуры стёкол.
Так как стёкла в большинстве случаев
являются техническими продуктами и возможны очень широкие варианты выбора их
химического состава, взаимодействие ионов может приводить к образованию
структур различного типа. Положим, что в стёклах отсутствуют
микронеоднородности и ликвационный распад. В этом случае равновесное состояние
системы определяется её устойчивостью. Степень устойчивости стеклообразной
структуры может быть разная. При определённом наборе ионов устойчивость
стеклообразной структуры будет очень низкой. Это даёт возможность перейти
системе в другое состояние. Чрезвычайно низкую устойчивость системы можно
характеризовать как переохлаждённое состояние. Стеклообразные системы с низкой
степенью устойчивости являются частным случаем современных представлений о
стёклах, как переохлаждённых жидкостях.
5. ПРИНЦИПЫ
ПОСТРОЕНИЯ ФИЗИЧЕСКИХ ПОЛЕЙ В СТЁКЛАХ
Структура расплава при стеклообразовании
представляет динамическую систему, где каждый атом постоянно находится в
движении. Результат этого движения определяется коллективным взаимодействием
атомов всей системы не по законам геометрии, а по законам физики [13]. В первую
очередь структура стекла определяется тем набором атомов, который входит в её
состав, а также размерами этих атомов, которые располагаются в определённом
порядке благодаря электростатическому полю в системе. На образование структуры
стекла оказывают влияние также внешнее давление и гравитационное поле.
Если в системе, представляющей собой набор
некоторого количества разнородных атомов, то есть некристаллической системе –
стекле, последовательно каждый атом заменить силами, которые сохраняют систему
в равновесном состоянии, получим поле векторов, расположенных в пространстве.
При этом вектора имеют разные модули и различное направление. Таким образом,
систему можно представить векторным полем, не обязательно, чтобы вектора
соответствовали направлению химических связей.
Рассмотрим систему из двух атомов. Если
один из атомов заменим силой, чтобы система была в равновесии, сила должна
действовать по направлению химической связи. Но если в системе три атома, тогда
силы действуют не по кратчайшему расстоянию между атомами. Вектора сил при
замене ими химических связей могут быть направлены и в противоположную сторону.
Это значит, что при воздействии скалярной величины (температуры) прочность
системы определяется суммой всех векторов. Но при воздействии векторной
величины (силы на растяжение) прочность системы будет определяться векторной
разностью сил системы, направленных в сторону, противоположную действующей
силе. Отсюда вытекает отсутствие корреляции таких свойств стекла как
температура начала размягчения и прочность.
Отличие атомного состава и невозможность
построения регулярной структурной сетки в системе приводит к отсутствию
ближнего порядка в системе векторов, то есть вектора имеют различную величину и
направление. Однако, в системе независимо от направления есть вектора,
одинаковые по модулю. Это дискретные уровни структуры стекла по силе связи. При
нагревании последовательный разрыв уровней связей по их силе приводит к
совершенно новой системе с иными уровнями сил связей.
6. СТРУКТУРА
СТЕКЛА
6.1. Подход к описанию структуры.
В работе [14] показано, что узлы
кристаллической решётки не являются точками, определяемые каким-либо внешним
силовым полем и соответствующим каким-то абсолютным положением равновесия
атомов. Определяющее поле – поле внутреннее, создаваемое самими атомами.
Структура жидкого аморфного тела может быть охарактеризована функцией
относительной плотности, но эту задачу легче сформулировать, чем выполнить. В
работе [15] указывается, что и для определения сил, удерживающих атомы в узлах
правильной кристаллической решётки нужно делать приближения, что ядра атомов
считаются покоящимися. Для минералов по современным законам кристаллохимии [16]
структура определяется величиной межатомных расстояний, состоянием
ионно-ковалентной связи, соотношением валентностей и относительных количеств
различных атомов, строением их наружной электронной оболочки.
Для стёкол эта задача невыполнима. В
структуре стекла расположение атомов одновременно является как причиной, так и
следствием наличия внутреннего поля, характеризующего взаимодействие атомов
друг с другом. Точно описать расположение атомов в структуре стекла и силы, их
заменяющие, не представляется возможным, для понимания физических свойств
стёкол от состава достаточно интегральной картины строения стекла.
6.2. Структура стекла не случайна.
Надо полагать, что стеклообразная структура
является также вполне естественной, как и все другие. Стеклообразная структура
должна иметь дальний порядок, если стекло приближается к идеальному. Однако,
отклонения от идеального стекла способствует нарушению идеальной структуры и
ведут к неоднородностям.
Твёрдое тело – сложная макроскопическая
система частиц, находящихся в состоянии термодинамического равновесия [17]. При
изменении внешних условий равновесие нарушается, и система в результате очень
сложной внутренней перестройки переходит в новое состояние равновесия. В работе
[14, стр.77] показано, что степень порядка в структуре зависит не только от
температуры, а также от внешнего давления, которому подвергается тело.
При изучении спектров
натрийсиликатных стёкол в зависимости от состава и тепловой обработки сделан
вывод, что распределение атомов в стекле не является полностью беспорядочным
[18].
На неслучайную структуру стёкол
указывается и в работе [19]. В аморфных телах отсутствует трёхмерная
периодичность, но расположение атомов в таких телах совершенно не случайно, как
это имеет место в газах. Силы связи, действующие между атомами в жидкости,
близки к тем, которые действуют в кристалле. Хотя отсутствует дальний порядок,
но сохраняется ближний порядок, существующий на небольшом числе постоянных
решётки.
В свинцовосиликатных стёклах
[20] уже в расплаве ионы свинца располагаются не хаотически по статистическим
законам, а грубо приближённо так, как в соответствующих силикатах, которые
выкристаллизовываются при данном составе.
Фаза, устойчивая в определённой области
температур и давлений, может превратиться в другую фазу, если изменится одна
или обе переменные [21]. Как и в твёрдых растворах замещения, в стёклах атомы
одного сорта должны иметь возможность разместиться среди атомов другого сорта.
Наличие ликвации и микронеоднородностей в
стёклах говорит о том, что в каждом конкретном случае структура стекла является
не просто случайной, а строго определённой. Набор атомов, входящих в состав
стекла, выстраивает оптимальную в энергетическом аспекте структуру, и те атомы,
которые не вписываются в данный характер структуры, образуют стёкла иного
состава (ликвация) или микронеоднородности. То есть любое стекло имеет дальний
порядок, и благодаря различному химическому составу только ему присущее
строение, где входящие в состав его атомы строят стеклообразную решётку на
принципах химической связи.
6.3. Представления о структуре стекла.
Несмотря на трудности описания структуры
стекла на атомном уровне делаются гипотетические попытки представить эту
структуру. В работе [22] предполагается, что атомы натрия помещаются в
различных «дырках» стеклообразной решётки, преимущественно у односторонне
связанных с кремнием атомов кислорода, балансируя их валентность. В работе [10,
стр.301] указывается, что у кристаллов и твёрдых аморфных тел ближний порядок
один и тот же. В противоположность кристаллам в неорганических стёклах ионы не
входят в состав координационной сетки, а статистически распределены в свободных
местах.
Кристаллохимическая (или ионная) теория
строения стекла [23] предполагает ионный тип связи в стекле, в то время как
полимерная теория исходит из преимущественно ковалентного характера химических
связей. Исследование природы химической связи в неорганических стёклах, её
изменений при переходе кристалл – стекло позволит по-новому взглянуть на
природу стеклообразного состояния. Однако, проблема химической связи даже для
простых тел и соединений, как кристаллических, жидких и аморфных, является
основным звеном в разветвлённой цепи вопросов физики и химии полупроводников
[24]. Теоретические исследования химической связи оторваны от экспериментальных
работ. Проблема химической связи в полупроводниках и твёрдых телах должна
решаться комплексно на базе экспериментальных работ и их теоретического
анализа.
Даже в кристаллах, имеющих упорядоченное
строение, нет ясности о характере химических связей, тем более сроить
гипотетические модели химических связей в стёклах не перспективно. Для
понимания процесса стеклообразования важно знать, что стекло не просто
статистической набор атомов, образующих бесформенную, аморфную структуру. В
работе [25] указывается, что природные процессы подчиняются первому и второму
принципу термодинамики, то есть идут в направлении уменьшения свободной энергии
системы с отчётливым стремлением к образованию соединений с максимальной
энергией химической связи.
В работе [26] утверждается, что
последовательное квантомеханическое рассмотрение сил связи в кристаллах в
настоящее время практически невозможно. Структура кристаллической решётки
определяется характером сил связи и позволяет сделать ряд заключений об их
особенностях, но эта связь не однозначна и может служить лишь одним из
аргументов в пользу тех или иных предположений о силах связей.
Тем более в стёклах с их сложной
неопределённой структурой определять тип связи не имеет смысла. Не энергия
решётки в структурах является первичной, более близко стоит к сути характер сил
связи, но и характер сил связей определяется зарядами атомов. Заряды атомов
являются не точечными, а поляризуются и при стеклообразовании образуют
коллективную связь, каждый из атомов занимает положение с наименьшей
потенциальной энергией.
Понять природу стекла пытались, используя
различные подходы. Автор работы [27] полагает, что строение вещества в
значительной степени зависит от характера химических связей между атомами, и
поэтому изучение окислов к стеклообразованию целесообразно начать с изучения
характера химической связи в окислах и его влияния на их внутреннюю структуру.
Однако, нет никаких указаний, как это сделать. Но одновременно предполагает,
что простые однокомпонентные неорганические стёкла не имеют существенного
отличия от органического стекла – состоят из небольших молекул, связанных
значительными межмолекулярными силами. В работе [28] также изменение свойств
стёкол связывается со строением и свойствами атомов: числа электронов и заряда
ядра, характера внешнего электронного слоя, размеров иона, квантовых
характеристик, а также от характера и силы химических связей, возникающих между
отдельными компонентами.
Беда в том, что ставится совершенно
невыполнимая задача, и разгадать тайну строения стекла с помощью таких гипотез
не представляется возможным. Положения атомов компонентов, входящих в стекло,
характеризуется их электрическими свойствами. Именно электрические заряды
атомов расставляют их в определённом порядке, чтобы система была электрически
нейтральна, и все атомы в ней имели наименьший потенциал и наибольшую силу
связи. Образуется коллективная химическая связь, о которой уже упоминалось
выше. Нельзя согласиться с тем, что катионы модификаторов находятся в пустотах
между анионами и распределены статистически, образуя аморфную структуру.
Структура стекла строится по тем же принципам, что и кристаллов, это общие
законы строения твёрдых тел. В работе [21, стр. 253] говорится, что любой
ионный кристалл по своей структуре представляет собой правильно чередующееся
расположение положительных и отрицательных ионов. Между этими ионами действуют
силы притяжения и отталкивания, равновесие между которыми и определяет
фактически существующие в кристалле межионные расстояния. В кристаллах с ионной
связью [29] ионы расположены периодически и вокруг каждого отрицательного иона
находится несколько положительных, а вокруг положительных несколько
отрицательных. Устойчивость того или иного типа координации в структуре [30]
определяется таким взаимным расположением, которое исключает соприкосновение
одинаковых и, стало быть, одноимённо заряженных ионов.
При исследовании натриевокальциевосиликатных
стёкол [31] анализ характера изменений кривых ликвидуса показал, что в области
температур 10000С количество атомов кислорода, окружающих катионы
модифицирующих добавок, определяется соотношением их радиусов. В работе [19,
стр. 141] для корректных результатов при исследовании свойств полупроводников
следует учитывать влияние дальнодействующих кулоновских сил. Также и в стёклах,
не так важно установить конкретно, какие связи образуются. При отсутствии
регулярной сетки структуры не только атомы, координирующие с каким-то атомом,
играют преобладающую роль в создании структуры, но важны и дальнодействующие
силы. В стекле образуется коллективная химическая связь.
При исследовании инфракрасных спектров в работе
[32] установлено, что образование силикатного расплава характеризуется
возникновением и развитием устойчивых связей между ионами в момент
взаимодействия компонентов расплава. В работе [30, стр. 89] говорится о
принципе построения кристаллической решётки: внутренняя энергия веществ есть
функция размещения атомов. Чем большее число связей, образованных каждым
атомом, и чем ближе атомы расположены друг к другу, тем меньше внутренняя
энергия. По таким же принципам строится и стекловидная решётка.
Автор работы [33], изучая спектры
комбинационного рассеяния титаносодержащих силикатных, германатных, боратных и
фосфатных стёкол, доказал тетраэдрическую координацию титана. Высказано и
обосновано предположение, что некоторая часть титана имеет координационное
число пять. Возможно, важно знать координацию титана в стёклах, однако, знание
координации титана ничего не даёт в понимание сути стеклообразного состояния
вещества.
Есть в стекле химические соединения или
нет? Надо определиться, что в данном случае понимать под химическим
соединением. Для кристаллических веществ химическое соединение в нормальных
условиях всегда определённо. Но факт, что химическое соединение – это
возможность взаимного сосуществования атомов, способных прочно удерживаться
друг возле друга. С этой точки зрения в стекле есть химические соединения, но
они неопределённого состава, то есть нестандартные химические соединения. Что
же удерживает все атомы стекла в едином блоке? Этой силой является коллективная
химическая связь. Стекло – такое сочетание или искусственная смесь анионов и
катионов, которые при расплавлении кристаллических компонентов стекла не имеют
возможности в природных условиях создать кристаллическую структуру и вынуждены
образовывать то соседство, которое возможно. Силами, приводящими к образованию
твёрдого тела, являются силы электрических зарядов атомов. Атомы стремятся
занять положение с минимальной потенциальной энергией и максимальной прочностью
связей между ними. Отсюда – различные по силе химические связи в структуре
стекла, определяющие природу стеклообразного состояния.
6.4. Координация ионов в стекле.
Многие материалы, относящиеся к классу
керамических, являются ионными кристаллами [21, стр. 360]. В кристаллах,
состоящих из атомов нескольких элементов, атомы одного элемента стремятся
захватить электроны от атомов другого (или других) вследствие различной
электронной структуры этих элементов. Возникшая композиция называется ионным
соединением.
Под понятием окислов в стекле [34] следует
подразумевать не изолированные (отдельные, дискретные) молекулы, которых нет и
в чистых стеклообразующих окислах, а совокупность ионов кислорода и ионов
электроположительных элементов, находящихся между собой в определённых
количественных соотношениях и расположенных взаимно по принципу координации.
В работе [12, стр. 139] при исследовании
бариевосиликатных стёкол указывается, что рассмотрение отдельных связей барий –
кислород и кремний – кислород на коэффициент термического расширения является
сильным упрощением реального положения вещей. Действительно, на свойства стекла
оказывают влияние не характеристики отдельных химических связей, а коллективная
связь, которая интегрально реагирует на внешние воздействия на систему.
При исследовании силикатного стекла [35],
в котором модифицирующими были окислы стронция, алюминия и титана, установлено,
что введение двуокиси титана способствует увеличению в стекле количества 4-х
координационного алюминия. Алюминий в свою очередь влияет на структурное
состояние титана: с повышением в стекле атомов алюминия увеличивается
количество 6-ти координационного титана. Автор работы [36] выдвинул теорию
экранирования при стеклообразовании. В основе её лежит представление о
частичной временной незащищённости ядер при диффузии, имеющих более низкое
координационное число. Теория экранирования предполагает, что даже ионы
щелочных металлов в значительной степени влияют на структуру при
стеклообразовании из расплава.
Эти исследования подтверждают, что
структура стекла является единой системой, в которой нет локальных изменений, а
всё влияет на всё, то есть введение в состав стекла какого-нибудь компонента
изменяет всю структуру. Введение различных окислов в кремнекислородный каркас
стекла не только приводит к их рассредоточению в пустотах, но и существенным
образом изменяет расположение всех атомов. Происходит активное взаимодействие
атомов друг с другом. В работе [21 стр. 105] показано, что размещение в
кристаллической структуре атомов одного сорта всегда так или иначе связано с
расположением атомов другого сорта. Их упорядочение связано с небольшим
различием сил взаимодействия между соседними атомами. Тем более, взаимное
влияние атомов друг на друга должно быть в стёклах, в структуре которых нет
регулярной решётки.
В работе [37] высказано мнение, что при
избытке в стеклообразном полупроводнике какого-либо компонента по сравнению со
стехиометрией соответствующего кристалла, атомы этого компонента в стекле, в
отличие от кристалла, не будут разделены вакансиями недостающих элементов, а могут
замкнуть свои валентности друг на друга. Ещё Я.Френкель [14] указывал на то,
что соседние атомы кристалла очень сильно взаимодействуют друг с другом.
Строгое обоснование его представляет собой сложную задачу, которую до сих пор
никто не пытался решать. Но при рассмотрении колебательного движения было бы
правильнее трактовать все атомы тела как единую связанную систему.
Система кремнезёма является весьма сложной
[38]. Представление, что каждый атом кислорода связан с двумя атомами кремния и
является общим для двух соседних тетраэдров, что в результате даёт непрерывную
структуру каркасного типа, является схематичным и упрощённым. В
действительности каждый атом кислорода связан не только с двумя соседними
атомами кремния, но в силу делокализации электронов в какой-то мере и с другими
близлежащими атомами кремния и кислорода, что резко усложняет фактическую
картину распределения электронной плотности.
В массивном теле имеется равновесное
положение атомов согласно их заряда, который определяет силу взаимодействия
атома со всем окружением. Фактически нельзя сказать, что данному аниону
принадлежит именно этот катион. Поэтому можно считать, что любой ион
уравновешивает все заряды, координирующие с рассматриваемым ионом, хотя
основная часть заряда идёт именно на это взаимодействие, а дальше на
взаимодействие с зарядами второй сферы и так далее. Это взаимодействие и
является, по-видимому, ответственным за прочность вещества. Если каждый ион
взаимодействует со многими, то можно сказать, что валентность элемента –
величина статистическая. Благодаря такому взаимодействию образуется
коллективная химическая связь в твёрдом теле, в том числе и в стекле.
В работе [39] указывается, что ближний
порядок около различных стеклообразных элементов различен, так как у них разные
координационные числа. Но если все компоненты стекла полностью смешиваются
между собой, то вся стеклообразная система релаксирует как одно целое.
Аналогичное мнение высказывается в работе [21, стр. 245]: ионные кристаллы –
это главным образом неорганические соединения. Для них можно записать вполне
определённую химическую формулу. Правильнее считать весь кристалл гигантской
молекулой, в которой данный ион испытывает значительное воздействие со стороны
всех остальных ионов.
В работе [40] говорится, что в
кристаллохимии с помощью рентгеновского анализа давно установлено, что решётки
шлакообразующих окислов являются координационными. Это означает, что атомы в
кристалле располагаются так, что нельзя с достаточным основанием выделить
какие-либо обособленные группы. В работе [41] высказана мысль, что носителями
свойств твёрдого вещества является не молекула, а реальное твёрдое тело,
выступающее в химических реакциях как единая квантомеханическая система.
6.5. Особенности структуры стекла.
Главной особенностью кристаллических
решёток окислов является простое кубическое или плотно упакованное расположение
ионов кислорода [29, стр.23]. Учитывая трудности точных энергетических
расчётов, некоторые авторы стали на путь использования представлений теории
плотной упаковки [13, стр. 160]. Однако, в кремнезёме при нормальном давлении
не соблюдается принцип плотнейшей упаковки, характерной для ионных кристаллов
[38].
Сложности описания структуры стекла
приведены в работе [42]. В стёклах пространственная группа, характеризующаяся
расположением атомов в структурной сетке стекла, не имеет никаких элементов
симметрии. Поэтому геометрическую структуру можно определить, только задав
координаты всех атомов. Однако, это практически невозможно. В работе [43] установлено,
что при температуре Tg объём стекла
больше, чем объём, который имела бы жидкость при этих температурах. Замедление
скорости переупаковки молекул является причиной повышенного объёма стекла.
Расчёт показывает, что стекло, в особенности с высоким Tg , имеет рыхлую структуру.
В работе [19] указывается, что для полного
описания свойств аморфного тела требуется знать его структуру. Если даже
учитывать лишь парные взаимодействия отдельных атомов и ограничиться ближним
порядком, то возможно огромное количество различных структур для любого
аморфного материала. Вывод о многообразии структур стекла подтверждается в
работе [44] – каждому химическому составу присуща своя специфическая структура.
Структура стекла не имеет регулярной
сетки, как в кристаллических веществах. Ионы в стекле находятся только в узлах,
междоузлий как таковых нет. Хотя в структуре могут быть пространства между
анионами, не заполненные катионами, но они не могут быть вакансиями. Только под
действием внешних сил может изменяться положение ионов в стекле. Стекло –
упорядоченная система с переменной структурой. При изменении свойств с
изменением температуры изменяется и сама система. Отсюда зачастую сложные и
необъяснимые изменения свойств в зависимости от температуры. При нагревании
кристаллических веществ изменяется кинетическая энергия ионов, однако, их
расположение относительно друг друга не меняется. Стекло представляет собой
иную картину при изменении температуры. Все ионы при нагревании стекла начинают
увеличивать кинетическую энергию, но большая неравномерность сил связей между
ними приводит к разрыву самых слабых. Разрыв этих связей немедленно ведёт к
изменению местонахождения остальных ионов.
Упорядоченность стекла характеризуется
тем, что в данных условиях образуется самая стабильная ситуация расположения
отдельных ионов. При этом стекло не может обладать ближним порядком, а имеет
приведенный дальний порядок с дискретным распределением всех связей по их силе.
Возможно, что в стёклах даже при комнатной температуре есть связи, для которых
эта температура достаточна для разрыва. Отсюда интересно изучение свойств
стёкол при низких температурах.
В настоящее время распространено
представление о наличии ближнего порядка и отсутствии дальнего на основании
представлений о стекле как жидкости. Признание наличия ближнего порядка
обязательно должно привести к признанию дальнего путём рассмотрения
последовательного ряда соседних атомов (закон транзитивности). Если A →
B, B → C, то A →
C и
т.д. Следовательно, в стекле нет ближнего порядка, а в ближнем окружении
каждого иона образуется устойчивая система из тех ионов, которые его окружают.
Но и нет дальнего порядка в том понимании, который имеется в кристаллических
телах. Имеется так называемый приведенный дальний порядок, когда идентичные
элементы структуры не совпадают по вектору, но имеют одинаковые силы связи. Эти
структуры представляют собой химические соединения неопределённого состава [4].
Эти представления относятся только к однородному, истинному стеклу. Наличие
неоднородностей в стекле не позволяет считать его истинным стеклом.
В работе [45] делается вывод,
что в отличие от кристаллов, в которых исходные компоненты находятся между
собой в определённых простых количественных соотношениях, в стекле окислы могут
вступать в соединение в любых количествах. Но это не совсем так, однородные,
истинные стёкла можно получить в узком интервале изменения химического состава.
Каждый химический состав стекла имеет
только ему присущее строение атомной структуры. В работе [46] показано, что,
изменяя состав стекла, можно непрерывно изменять окружение парамагнитного иона,
то есть изменять его координацию и силу поля.
7. ДИСКРЕТНЫЕ УРОВНИ СИЛ СВЯЗЕЙ В СТРУКТУРЕ СТЁКОЛ
В работе [47] высказано мнение, что если в
некоторый момент свойства системы изменяются скачком, то приходится полагать,
что здесь появляются новые фазы. Дискретное изменение свойств стёкол наступает
при составе, близком к фазовой границе диаграмм равновесия. Предполагается, что
в стёклах есть какие-то образования, которые исчезают и возникают, приводя к
дискретному изменению фаз стекла. В работе [48] рассмотрены взгляды
Д.И.Менделеева на строение стекла. В стекле существует одновременно во
взаимодействии прочная, трудноизменяемая и определяющая главные свойства
вещества основа и легко изменяемая, относительно мало влияющая на свойства
часть.
Противоположное мнение высказано в работе
[49]. Критикуя представления о молекулярном строении силикатов, поскольку молекул
в силикатах нет, автор отвергает идею объединения этих молекул и образование в
стекле структурных групп. Вопреки этому мнению в работе [50] указывается, что
при исследовании структуры стекла интерес представляет не только его
атомно-молекулярная структура. Помимо её, изучению подлежит и вторичная и даже
третичная структура. Важно знать не только структуру составляющих стекло
молекул, но и характер их агрегации.
В связи с наличием слабых и
сильных взаимодействий в стёклах авторы работы [51] высказали предположение о
наличии в них нескольких более или менее прочных структур, находящихся в
равновесии. Изменение ряда свойств стёкол с температурой и давлением авторы
связывают с происходящим при этом количественном изменении соотношений
различных структур в стекле.
Автор работы [52] рассматривает
многокомпонентные стёкла как гетеродинамические структуры, которые имеют два
или больше сортов связей. Эти связи различаются энергией и силовыми
коэффициентами. За счёт более жёстких связей образована сетка стеклообразователя,
более слабыми связями присоединены к сетке катионы металлов. В работе [23,
стр.47] экспериментально показано, что даже в случае кварцевого стекла имеется
несколько различных состояний кислорода. При рентгеновском исследовании
кварцевого стекла в работе [50, стр. 58, 123] установлено, что часть линий
рентгенограммы принадлежит кварцу, часть другим веществам, природа которых не
была определена. Очевидно, что стекло, даже простое кварцевое, представляет
собой сложную систему, состоящую из самых разнообразных по структуре участков,
среди которых могут встречаться и области с известными структурами.
При разработке агрегативной теории
строения стекла автор работы [53] О.К.Ботвинкин считал, что при стекловании в
структуре стекла происходит образование агрегатов путём объединения лишь
одинаковых молекул. Из этого вытекало чрезвычайно важное следствие о
существовании для других молекул второй, своей температуры агрегации. Таким
образом, в сложных сплавах, в которых существует несколько недиссоциированных
на ионы химических соединений, число точек
Tg будет равно
числу различных молекул.
Автор кристаллитной теории строения стекла
А.А.Лебедев [54] обратил внимание на скачкообразные изменения некоторых свойств
стёкол при определённых температурах. А.А.Лебедев в [55] указал, что
отказываться от представления о наличии в стекле кристаллитов нет оснований. На
существование кристаллитов убедительно указывают низкотемпературные точки
превращения. В работе [56] показано, что практически у всех стёкол при
температуре порядка 450-5000С обнаруживается более или менее резкое
изменение всех физических свойств. Существует переход некой низкотемпературной
модификации в высокотемпературную. Этот переход в стекле совершается не сразу,
а происходит постепенно внутри значительного интервала температур. Не
приходится сомневаться в том, что в стёклах существуют структурные превращения.
В чём заключается сущность этих превращений пока не ясно. Если ранее
А.А.Лебедев связывал эти превращения с модификациями кварца, то дальнейшие
исследования показали, что подобные превращения наблюдаются в боратных стёклах
и во всех стеклообразных телах.
В работе [57] исследован коэффициент
термического расширения стёкол. В ряде предыдущих работ были обнаружены
аномалии в температурной зависимости КТР. Считалось, что скачкообразные
изменения КТР – результат погрешности измерения, поэтому относительное линейное
расширение изображается обычно в виде плавной кривой или прямой. В результате
исследований на кривых относительного линейного удлинения для всех стёкол
получены скачки, которым соответствуют скачки КТР на температурной зависимости
тех же стёкол. Некоторые изломы и скачки совпадают по температуре у всех
исследованных стёкол, другие изломы в широком интервале температур и являются
как бы характерными для каждого стекла. Эти изломы не могут быть объяснены ни
колебаниями скорости нагревания, ни приборными ошибками, ни погрешностями
измерений, поскольку принятая методика исключает последствия. Но приведенный
материал пока не даёт авторам оснований для более глубоких обобщений и
объяснения причин аномального хода КТР.
При измерениях расширения стекла в работе
[58] на кривых расширения также обнаружены скачки. Делается вывод, что
изменение свойств стёкол в зависимости от температуры может быть разбито на ряд
этапов. Создаётся впечатление, что процесс застывания стекла не только
растягивается на широкую область температур отжига, но и распадается на ряд
ступеней, которые заканчиваются при различных и иногда весьма низких температурах.
При исследовании температурной зависимости показателя преломления ряда стёкол
установлено [59], что существуют его структурные изменения: на кривой имеются
переломы и горизонтальные площадки. Наличие таких превращений в силикатных
стёклах возможно только при наличии в них пространственных группировок с более
или менее упорядоченным строением, то есть такие превращения служат
доказательством существования в этих стёклах кристаллов.
Наличие дискретных уровней по силе связи в
стекле может быть разным. Дискретные уровни создают структурные группы,
образующиеся в стекле при стекловании. Чем меньше структурных групп, образующих
площадки на кривых зависимости свойств от состава, тем лучше стекло по
технологическим и термическим свойствам. Отсюда вытекает необходимость
использовать в промышленных стёклах большое число компонентов, что даёт
возможность получить большую гамму связей с различной силой. Такие стёкла будут
более «длинными» при выработке. Аналогичное мнение высказано в работе [60]: при
усложнении состава наличие в стекле различных, пространственно не согласующихся
структурных единиц, затрудняет его кристаллизацию.
8. О ДАЛЬНЕМ
ПОРЯДКЕ В АТОМНОЙ СТРУКТУРЕ СТЁКОЛ
При охлаждении жидкостей они всё более
приобретают сходство с кристаллическими телами [61]. Закономерность
расположения центров колебания частиц в решётках кристаллов, обнаруживаемые на
любых больших расстояниях, определяет дальний порядок. Ближний порядок –
правильность расположения около каждой частицы частиц ближнего окружения.
Наличие дальнего порядка является определяющим свойством кристалла [62]. В
других твёрдых телах отсутствует дальний порядок расположения составляющих их
частиц и эти тела правильнее считать переохлаждёнными жидкостями. К таким
веществам относится стекло – аморфное, бесформенное твёрдое тело. Однако,
аморфные тела обнаруживают ближний порядок в своём строении. Аналогичным
образом об отсутствии дальнего порядка и наличия ближнего порядка в аморфных
телах рассуждают авторы работы [19, 63]. Автор работы [64] считает, что при
переходе из устойчивого жидкого состояния в стеклообразное вещество не может
приспособиться к изменившейся температуре. Структура стекла, как и жидкости,
характеризуется отсутствием дальнего порядка. Под этим подразумевается
отсутствие на значительных расстояниях систематической повторяемости
элементарной ячейки.
В отличие от установившегося общего мнения
об отсутствии в стёклах дальнего порядка, в работе [65] высказана оригинальная
и интересная мысль, что хотя стёкла не обладают дальним геометрическим
порядком, но стёкла могут иметь дальний структурно-химический порядок. В работе
[10, стр.12] приведены результаты рентгенографического исследования
стеклообразного кварца. На кривой распределения интенсивности получены явно
выраженные максимумы. Вначале эти максимумы толковались как признаки дальнего
порядка в аморфном состоянии. Но в аморфной модификации кварца соблюдается
только ближний порядок в пределах каждой элементарной ячейки, построенной так
же, как в кристалле. За пределом ячейки порядок нарушается. Это происходит
потому, что каждая следующая ячейка несколько повёрнута относительно
предыдущей, причём направление поворотов статистическое.
Отсутствие дальнего порядка в стёклах,
которое является общепринятым мнением, не способно объяснить дискретность
физико-химических свойств стекла. Для того, чтобы были переломы и скачки на
графиках температурной зависимости свойств, в стекле должны быть структурные
группы, обладающими одинаковой силой связей. Основываясь на экспериментальных данных
по температурной зависимости свойств стёкол, можно утверждать, что в стекле
есть дальний порядок. Исходя из представлений о структуре стекла как о наборе
различных по силе связей, среди которых происходит их повторение, можно
говорить о наличии дальнего порядка в стекле. В отличие от дальнего порядка в
кристаллах, когда можно элементарную ячейку транслировать на любое количество
узлов, дальний порядок в стёклах можно определить как приведенный дальний
порядок. Приведенный дальний порядок в стекле полагает возможность трансляции
элементарной ячейки на некоторое расстояние с допущением вращения этой ячейки
на некоторый угол. Исходя из предположения о наличии приведенного дальнего
порядка, следует сказать об отсутствии ближнего порядка в стёклах. Если бы в
стёклах был ближний порядок, он сохранился бы и в соседних атомах, и так далее
на любом расстоянии. Наличие ближнего порядка предопределяет и наличие дальнего
порядка. Любое стекло, не имеющее микронеоднородностей, имеет дальний
приведенный порядок и благодаря различному химическому составу только ему
присущее строение. Атомы, входящие в состав стекла, расположены в структуре не
статистически, а строят стеклообразную решётку на принципах химической связи.
Стекло следует рассматривать как объект с переменной структурой.
9. СПЕКТРЫ СТЁКОЛ
И КРИСТАЛЛОВ
При исследовании энергетического спектра
электронов в кристаллических и стеклообразных халькогенидах мышьяка в работе
[66] установлено, что существует сходство спектров стёкол и кристаллов. При
переходе кристалла в стекло наблюдаются некоторые характерные изменения в
спектрах отражения. Полосы отражения в спектрах более размыты, чем в
кристаллах, и не содержат тонкую структуру. Авторы работы считают, что
стеклообразные полупроводники являются веществами с нарушенным дальним
порядком. В работе [67] анализ экспериментальных данных по временной
зависимости стабилизации диэлектрической постоянной стёкол позволяет
предположить, что в стёклах существует широко размытый спектр частот
релаксации. Методом стоячих волн измерены диэлектрические свойства различных
стёкол [68]. Обнаружены компоненты потерь, связанные с вибрацией ионов. Большие
времена релаксаций этих колебаний и случайная структура сетки стекла, в которую
беспорядочно включены ионы разных сортов, являются главными причинами
расширения пика резонансных потерь.
Исследование спектра ИК отражения
кристаллического и стеклообразного CdGeP2 в работе [69] показало, что спектр отражения стекла
не имеет таких пиков, как в кристалле, а представляет плавную кривую.
Размытость спектра стекла по сравнению с кристаллом связана с отсутствием в
стеклообразных соединениях дальнего порядка и с наличием некоторой
неупорядоченности в ближайшем окружении. При исследовании ИК спектров
свинцовосиликатных стёкол установлено совпадение частот в спектрах
кристаллических и стеклообразных силикатов [70]. Совпадение частот указывает на
то, что в стекле существуют группировки с расположением атомов, сходным с
расположением их в решётке кристаллических силикатов. Широкие контуры полос в
спектрах стёкол могут быть обусловлены не тем, что структура стекла
беспорядочна, а тем, что такой контур представляет суперпозицию спектров ряда
упорядоченных структур, присутствующих в микроструктуре стекла.
Спектры комбинационного рассеяния
кварцевого и натриевосиликатного стёкол [71] во многих областях отличаются по
положению частот, относительной интенсивности и контуру линий от
соответствующих по составу кристаллов. Это несовпадение говорит о том, что,
по-видимому, сетку стеклообразного кремнезёма нельзя считать испорченной
решёткой кристаллического кварца. Расположение атомов в них различно, что и
определяет различие собственных частот в спектре этих тел. На спектрах имеется
не суперпозиция спектров кварца и метасиликата, а плавный переход, что говорит
за постепенное изменение структуры сетки стекла. В работе [42] отсутствие чётко
определённого энергетического спектра связывается с аморфным состоянием стекла.
В стёклах имеется набор чередующихся разрешённых и запрещённых зон энергий. При
исследовании ИК спектров простейших стёкол разного производства в работе [18]
установлено, что структура плавленого кварца является сложной и неоднородной.
Сопоставление большого числа спектров показало, что имеется много тонких
деталей в спектрах. За этими деталями скрываются структурные различия, которые
пока что остаются совершенно неясными.
Сравнение ИК спектров поглощения
пиросиликатов лития в кристаллическом и стеклообразном состоянии демонстрирует
аналогию в расположении полос и их относительной интенсивности [72]. Такая
близость колебательных спектров свидетельствует о близкой структурной аналогии
сетки стеклообразного пиросиликата лития решётке кристаллического соединения.
Отсутствие дальнего порядка в стекле приводит к расширению полос поглощения.
В работе [73] проведен рентгеноструктурный
анализ стеклообразного CdGeP2 . При сравнении распределения интенсивности
рентгеновского излучения стекла и поликристалла наблюдалось соответствие
положений диффузионных максимумов и линий максимальной интенсивности. Возможно,
этот факт свидетельствует о близости структур ближнего порядка. Изучение
свинцовосиликатных стёкол с помощью рентгеновского анализа [74] показало, что
дифракционные картины стёкол находятся в хорошем соответствии с рентгенограммами
кристаллических соединений. При увеличении содержания свинца появляются новые
пики, которые повторяются в определённом порядке, что указывает на ориентацию
группировок, содержащих ионы свинца. ИК спектры отражения стекла состава
бисиликата натрия изучены в работе [75]. Из сходства спектров стекла и
закристаллизованного стекла вытекает, что как закристаллизованное стекло
представляет смесь соединений, так и исходное стекло состоит из микрообластей
самых разнообразных составов, среди которых преобладают микроучастки
кремнезёма, высококремнезёмистых соединений и высокощелочных силикатов.
При введении в боросиликатные стёкла в
качестве добавок окислов молибдена, вольфрама и небольших количеств окиси
никеля наблюдается образование соединения, которое рентгенографически нельзя
отождествить ни с одной из известных модификаций кремнезёма [76]. Авторы работы
[18] при исследовании ИК спектров свинцовосиликатных стёкол помимо известных
силикатов свинца обнаружили добавочные полосы поглощения. Эти полосы относятся
к каким-то другим силикатам свинца, не отмеченным ещё на диаграмме равновесия
этой системы. В работе [77] отмечено, что сходство между структурами
кристаллических и стеклообразных силикатов заключается в существовании в обоих
состояниях кремнекислородного каркаса и в координационном принципе расположения
ионов относительно друг друга. Стекло как аморфное тело отнюдь не
бесструктурно.
Спектральные исследования различных стёкол
показывают, что стёкла в своей структуре имеют химические соединения. Эти химические
соединения неопределённого состава. По общепринятым представлениям аморфность
стекла предполагает неупорядоченную структурную сетку со статистически
расположенными в ней ионами модификаторов, но это не так. Хотя структура стекла
неупорядочена по сравнению с кристаллическими веществами, но это беспорядочный
порядок, что наглядно подтверждают экспериментальные исследования спектров
стёкол. В стекле имеется целый ряд структурных групп, которые идентичны по
строению, но отличаются по вектору. Этим объясняется размытость линий на
спектрах стёкол, которую наблюдали все исследователи.
10.
УПОРЯДОЧЕННОСТЬ В СТЕКЛЕ
Изучение спектров ЭПР в барийфторфосфатных
стёклах на основании сверхтонкой структуры в спектрах [78] позволило сделать
заключение о существовании в стекле геометрической упорядоченности. В этой
работе впервые экспериментально установлено наличие в стёклах порядка более
высокого, чем ближний, что имеет значение для теории стеклообразования. В
работе [18] при исследовании ИК спектров стёкол установлено, что связи,
характерные для определённых химических соединений, присущи стеклу, то есть в
стекле существуют группы с упорядоченным расположением атомов – кристаллиты.
Эти кристаллиты связаны между собой прослойкой, имеющей более беспорядочную структуру.
В работе [70] высказано мнение, что как в расплаве, так и в стекле существуют
группировки с расположением атомов, сходным с их расположением в решётке
кристаллов.
В работе [79] при исследовании
свинцовогерманатных стёкол установлено, что в стёклах присутствуют структуры,
отвечающие кристаллическим соединениям. В формировании структуры стекла в
большей или меньшей степени участвуют структурные образования, отвечающие всем
определённым химическим соединениям, возможным в этой системе. При исследовании
халькогенидов мышьяка [80], которые могут быть в кристаллическом и
стеклообразном состоянии, установлено, что энергетическая структура при
переходе кристалла в стекло в основном сохраняется. Стекло и кристалл одного и
того же состава по энергии взаимодействия атомов и ионов практически одинаковы.
В стеклообразных телах сохраняются многие существенные черты энергетических зон
твёрдых тел.
При исследовании свойств щёлочносиликатных
стёкол от состава [81] полученные результаты указывают на то, что их структура
не является совершенно беспорядочной. В этом случае зависимость свойств от
состава была бы линейна во всём интервале составов. На основе исследования
структуры стёкол методом ИК спектроскопии в работе [82] сделан вывод, что
микроструктура стекла неоднородна по химическому составу и в значительной
степени упорядочена.
Автор работы [77, стр.289] считает, что в
стекле имеются неопределённые химические соединения. Сущность таких соединений
в силикатных стёклах заключается в статистическом распределении ионов металлов
в среде кремнекислородного скелета. Однако, статистическое распределение ионов
металлов не означает отсутствия химического взаимодействия ионов с кремнезёмной
сеткой. Мыслится такое распределение, при котором сохраняется местная
нейтрализация положительных и отрицательных валентностей.
Работ, в которых имеются предпосылки к
упорядоченности структуры стёкол буквально единицы. Но стекло – упорядоченная
система, и эта упорядоченность не местного характера, она – статистическая.
Стекло в разных фрагментах идентично, свойства стёкол воспроизводятся в
образцах из различных варок стекла, что подтверждает закономерности образования
структурной сетки стекла. Наличие в стёклах микронеоднородностей и ликвационных
включений убедительно подтверждает закономерности образования определённой
упорядоченной структуры в стекле. Те атомы, которые не вписываются в мотив
данной структуры, выталкиваются ей и образуют или кристаллические соединения,
или стёкла иного химического состава. Наличие ликвации и микронеоднородностей в
реальных стёклах свидетельствуют о том, что в каждом конкретном случае
структура стекла является не просто случайностью, а строго определённой. В
случае аморфной, неупорядоченной структуры в стекле не было бы никаких микронеоднородностей,
происходило бы полное взаимное растворение фаз.
Разнообразие различных структурных
комплексов в стёклах очень велико. Исходя из представлений о структуре стекла
как о наборе различных связей, среди которых есть идентичные, можно говорить о
наличии в стеле дальнего порядка. В отличие от дальнего порядка в кристаллах,
которые состоят из подобных элементов ячеек и допускают трансляцию элементарной
ячейки на любое количество узлов решётки, дальний порядок в стёклах можно
определять как приведенный дальний порядок. Приведенный дальний порядок в
стекле полагает возможность трансляции элементарной ячейки на некоторое
расстояние с одновременным вращением её на некоторый угол. Элементарная ячейка
может состоять из любого количества элементов, элементарных ячеек в стекле
множество. При этом количество элементарных ячеек соответствует числу уровней
дискретности при переходе из расплава в твёрдое стекло.
Упорядоченность стекла характеризуется
тем, что в данных условиях образуется самая стабильная ситуация в расположении
ионов. Из положения о наличии приведенного дальнего порядка в стекле и из
представлений о построении структуры стекла вытекает, что стекло не может иметь
ближнего порядка. В настоящее время распространено представление о наличии ближнего
порядка и отсутствии дальнего на основании представлений о стекле как жидкости.
Признание наличия ближнего порядка обязательно должно привести к признанию
дальнего путём рассмотрения последовательного ряда соседних атомов (закон
транзитивности). Если A → B, B →
C, то A → C и т.д. Ближний
порядок в реальных стёклах может быть лишь в микронеоднородном стекле в
областях неоднородности, которые по своему строению приближаются к кристаллам.
Итак, по нашим представлениям структура
стёкол не имеет ближнего порядка в расположении атомов, но имеет дальний
приведенный порядок. Как частный случай возможен такой химический состав
стекла, что стекло не будет иметь приведенного дальнего порядка, но ближний
порядок вообще не присущ стеклообразному состоянию. Как раз отсутствие ближнего
порядка в стёклах и является главным их отличием от кристаллов в твёрдом
состоянии стекла.
11. ИЗМЕНЕНИЯ В
СТРУКТУРЕ СТЕКЛА ПРИ НАГРЕВАНИИ
Ещё в 1921году А.А.Лебедев [83] писал:
если верно то, что наблюдённые особенности в стёклах при нагревании являются
следствием перехода ά ↔
β кварца, то приходится заключить,
что в стекле имеются высокодисперсные кристаллы кварца, так как превращение при
5750, по всей видимости, следствие изменения кристаллической
решётки, то происходит физическая, а не химическая изомерия. В отличие от
стёкол [21, стр.64] в кристаллах тепловые колебания атомов не приводят к
серьёзным нарушениям структуры. Каждый атом находится в среднем на своём
собственном месте. Поэтому каждый атом окружён необходимым числом ближайших
соседей, которые расположены на расстояниях, примерно соответствующих
совершенной структуре.
Такой же подход, как к кристаллам с
регулярной решёткой, предложен в работе [84] и к стёклам. В твёрдом стекле его
структура (взаимное расположение частиц в решётке) изменяться не должна. При
изменении температуры твёрдого стекла происходит лишь некоторое изменение
расстояния между частицами при строгом сохранении их взаимного расположения.
Следовательно, в твёрдом стекле сохраняется структура, характерная для области
размягчения. Подобные взгляды идентичности поведения атомов в кристаллах и
стёклах приводятся в работе [10, стр. 12]. Атомы и молекулы кристалла или
стекла колеблются около своих центров равновесия с частотой порядка ν = 1013 кол/сек. Ближний
порядок, или взаимное расположение молекул твёрдого тела, не меняются с
температурой. Каждой температуре отвечает новое взаимное расположение молекул,
новая структура жидкости. При изучении релаксационных процессов, связанных с
изменением структуры переохлаждённого расплава от неравновесного состояния к
равновесному, в работе [12] сделан вывод, что любое изменение структуры стекла
связано с перемещениями составляющих стекло атомов или ионов относительно друг
друга. При этом перемещения должны затрагивать не только подвижные ионы типа
щелочных, но и те ионы или атомы, которые образуют наиболее прочные связи.
Исследование показателя преломления
закалённых и отожжённых стёкол в работе [83] показало, что полиморфное
превращение в стекле не мгновенное, а замедленное вязкостью среды, и имеет
характер, соответствующий превращению не чистых кристаллов, а твёрдых
растворов. Этот переход совершается в некотором интервале температуры, при этом
стекло проходит через непрерывный ряд равновесных состояний, и каждой
температуре соответствует своё особое состояние равновесия.
По мере охлаждения жидкости [85] всё время
происходит перестройка взаимного расположения молекул – их перегруппировка,
которая при более низких температурах происходит всё медленнее. Наконец, когда
температура такова, что время релаксации и вязкость становятся очень велики,
вероятность перегруппировок делается ничтожно малой. Автор работы [9] считает,
что для стеклообразного состояния структура – функция только температуры, а от
времени она практически не зависит. Но при этом указывает, что это упрощение
невозможно принять для переходной области. Каждой температуре соответствует
равновесная структура жидкости.
Повышение температуры стекла приводит к
изменению физико-химических свойств, что связано с изменением самой системы.
Отсюда появляется сложность в объяснении экспериментальных данных, и зачастую
возникают необъяснимые явления, называемые аномалиями свойств. При нагревании
или охлаждении кристаллических веществ изменяется кинетическая энергия ионов,
однако, их расположение относительно друг друга не меняется. Местоположением
иона можно считать среднее положение при его колебаниях. Температура плавления
кристаллических веществ – легко фиксируемая экспериментально температура, при
которой происходит резкий переход в другое энергетическое состояние. Это
происходит потому, что в кристаллических веществах сила связей одинакова. Когда
кинетическая энергия достигает силы химической связи, происходит её разрыв.
Стекло представляет собой иную картину.
При его нагревании начинают увеличивать свою кинетическую энергию все ионы,
однако, благодаря наличию в стекле целого спектра химических связей по их силе,
происходит поэтапный их разрыв. Когда разрываются самые слабые связи, система
немедленно реагирует на этот факт. Разрыв связей немедленно ведёт к изменению
местонахождения остальных ионов – система деформируется для сохранения
устойчивости. Так проявляется изменение структуры в стеклообразной системе при
нагревании, система обладает динамическими свойствами. Следовательно, стекло –
это упорядоченная система с переменной структурой, которая при повышении
температуры изменяет не только кинетическую энергию ионов, а также их
относительное расположение. Теоретически вполне возможно, что даже при
комнатной температуре есть связи, для которых эта температура является
достаточной для их разрыва. Такие стёкла будут очень значительно изменять свои
физико-химические свойства при охлаждении.
Выше температуры начала размягчения –
разрыва первых связей с ростом температуры, стекло хотя и представляет твёрдое
тело, но это уже гетерогенная система твёрдое тело – жидкость. По своей
конституции ионы с разорванными связями представляют жидкую фазу в
стеклообразном твёрдом теле. Дальнейший разрыв связей приводит к уменьшению
устойчивости системы и возможности переключения ещё жёстких связей. Тело
становится упруго-вязким. Процесс нагревания далее приводит к разрыву следующих
по силе связей и значительному ослаблению ещё не разорванных. Тело становится
вязким. Величина вязкости зависит от того, насколько полно произошёл процесс
разрыва дискретного спектра связей.
Таким образом, при нагревании стекло
последовательно изменяет механические свойства и проходит следующие стадии
своего состояния: упругое твёрдое тело; упругая гетерогенная система твёрдое
тело – жидкость; упруго-вязкое тело; вязкое тело. Стекло является хорошей
практической моделью для изучения механических свойств твёрдых тел.
Нагревание реальных стёкол в случае их
низкой устойчивости приводит к выделению кристаллов. Однако, есть целый ряд
стёкол, устойчивых к температурным воздействиям – внешний подвод тепла к
системе не изменяет её фазового состава. Таким стеклом является кварцевое
стекло. В ряду кварц – кварцевое стекло – расплав кварц является нестабильным
состоянием, а стекло и расплав – стабильными. Кристаллическое состояние
вещества не всегда является самым стабильным, идеальное стекло всегда
стабильно.
12. НЕОДНОРОДНОСТИ
В АТОМНОЙ СТРУКТУРЕ СТЁКОЛ
На основании ИКС в работах [82, 86]
показано, что в двухкомпонентных силикатных стёклах микроструктура неоднородна
по химическому составу. Также и у многокомпонентных стёкол структура
микронеоднородна, то есть неоднородности микроструктуры есть общее свойство
силикатных стёкол.
В работе [87] указывается, что хотя
изучению строения щёлочносиликатных стёкол посвящено много работ,
общепризнанные представления об их структуре отсутствуют. В щелочных стёклах
уже при малых содержаниях щелочного окисла образуются субмикроскопические
области, обогащённые ионами щелочного металла. При увеличении щёлочи число этих
областей увеличивается. Стекло становится всё более однородным. Однако ответить
на вопрос, когда достигается полная однородность, и достигается ли она вообще,
полученные экспериментальные данные не позволяют. Изучение структуры
таллийсиликатных стёкол методом рассеяния рентгеновских лучей [88] показало,
что ионы таллия в этих стёклах локализованы в отдельных структурных
группировках. Электронно-микроскопическое исследование стёкол
свидетельствовало, что фазовое разделение в них отсутствовало.
Исследование ИКС литиевосиликатных стёкол
[86, стр. 321] показано, что в стёклах имеются области, обогащённые кремнезёмом
и области, обогащённые ионами щелочного металла. Между этими областями с резко
различающимися свойствами лежат области силикатов промежуточного состава. На
основании инфракрасных спектров стёкол сделан вывод, что микронеоднородность и
упорядоченность структуры стекла существуют уже в расплаве. Эта неоднородность
не является следствием расслоения первоначального гомогенного состава, как
полагают некоторые исследователи, а существует уже при самом его возникновении.
13. НОВЫЙ ПОДХОД К
ПОНИМАНИЮ СТЕКЛООБРАЗНОГО СОСТОЯНИЯ
В науке в последнее десятилетие
распространилось мнение, что общей теории стеклообразного состояния не
существует и её невозможно создать. Такой вывод явился естественным результатом
неплодотворных усилий в этом направлении. Поэтому построение теории
стеклообразного состояния требует принципиально нового подхода, который не
является иной интерпретацией в рамках существующих критериев, а в корне
изменяет эти критерии и взгляды.
Потребность синтеза новых стёкол для
различных областей техники выдвигает необходимость прогнозирования их свойств.
В связи с этим проблема строения стекла имеет не только теоретический интерес,
а приобретает большое практическое значение. Определение структуры стекла
заключается в установлении характера расположения его отдельных элементов и
типа образуемых между ними связей. Знание структуры в свою очередь
предопределяет объяснение процесса фазового перехода расплав – твёрдое тело при
стеклообразовании и физико-химических свойств различных стёкол. В связи со
сложностью стекла как системы с неопределённым расположением атомов следует
стремиться понять не частные элементы структуры, а общие принципы и
закономерности стеклообразного состояния.
К настоящему времени накопилось множество
экспериментальных фактов, дальнейшая работа в этом направлении в большинстве
случаев не даёт новой информации. Едва ли следует ожидать получения
экспериментальных данных, которые внесут коренной перелом в представления о
стеклообразном состоянии и послужат основой для построения теории. Необходимо
ориентироваться на имеющийся материал, полученный различными методами, который
требует осмысления, обобщения, теоретического обсуждения и должен явиться
основой для построения теории стеклообразного состояния.
На основе анализа и обобщения большого
количества публикаций по гипотезам строения стекла, температурным и
концентрационным зависимостям физико-химических свойств нами предложен новый
подход к решению вопроса о природе стекла.
Прежде всего, следует сказать в отношении
неорганических стёкол, что хотя переохлаждение считается неотъемлемым от
стеклообразного состояния, но это не факт, доказанный экспериментом, а всего
лишь гипотеза. Независимо от масштабов признания любой гипотезы, пока она не
превратилась в теорию, имеет право на существование и любая другая гипотеза.
То, что при охлаждении расплавов
образуются стёкла, а не кристаллы, ещё недостаточный факт для утверждения о
переохлаждении. Таммановские постулаты о переохлаждении в связи с отсутствием
других объяснений стеклообразования были приняты, как аксиома, но в то же время
они легли тяжёлым бременем на сознание людей и препятствуют развитию теории
стеклообразного состояния.
В настоящее время переохлаждение считается
путём, процессом получения стекла. Однако, известно, что понижение температуры веществ
в любом агрегатном состоянии соответствует процессу охлаждения. Поэтому следует
сделать принципиальное замечание, что переохлаждение – не процесс, а состояние.
Система может перейти в это состояние только в результате охлаждения. Получать
стекло переохлаждением или использовать переохлаждение для этой цели не
представляется возможным. Кроме того, известно, что переохлаждение является
довольно редким случаем и система легко выводится из этого состояния. Для
стёкол же абсолютно всех составов переохлаждение считается основным путём их
получения, при этом переохлаждённое состояние очень устойчиво.
Неоправданной неточностью является
отождествление скорости охлаждения с переохлаждением. Пытаются в гипотезах
путём очень быстрого охлаждения зафиксировать структуру жидкости. Наивно
полагать, что скорость охлаждения будет выше скорости электронных и ионных
процессов перестройки структуры вещества, так как именно состояние вещества и
определяет его температуру.
Наши представления об отсутствии какой-либо
роли переохлаждения для образования стекла из расплавов развивались как одно
целое с теорией стеклообразного состояния и являются её неотъемлемой частью.
Следует заметить, что в реальных стёклах в
некоторых случаях возможно переохлаждение относительно отдельных микроучастков
структуры. Но это лишь вторичное переохлаждение, когда ряд атомов не могут
занять свои места в связи с тем, что уже образовалась основная структурная
сетка стекла.
Принцип о стекле как не переохлаждённой
жидкости используется для построения теории процесса фазового перехода
расплавов в твёрдые тела. Он диаметрально противоположен существующему
представлению. Из этого основного принципа как следствие вытекает
представление, что стекло – стабильное твёрдое тело.
Стеклообразное состояние – это состояние
стабильное, а не метастабильное. Если бы стекло было метастабильным,
расстекловывание должно было бы проходить самопроизвольно даже при низких
температурах. Однако, этого не происходит. То, что некоторая часть стекла в процессе
термообработки может перейти в кристаллическую фазу, ещё не говорит о том, что
эта система метастабильна, так как на такой переход надо затратить внешнюю
энергию.
Известно, что метастабильное состояние
является весьма чувствительным к внешним воздействиям. То, что удаётся путём
переохлаждения жидкости получить метастабильное состояние, которое невозможно
перевести в стабильное, говорит о стабильности так называемого «метастабильного
состояния».
Стеклообразное состояние – не
метастабильное, а более стабильное, чем соответствующее данному составу
кристаллическое (ситаллы). В литературе указывается, что самым стабильным
состоянием SiO2 является кристаллический кварц. Но это не так.
Стабильным состоянием при данном давлении и температуре является то, в которое
система возвращается после нагревания вплоть до расплавления. При нагревании
кристаллического кварца он необратимо переходит в другие модификации, и затем в
кварцевое стекло. Следовательно, стабильным состоянием SiO2 при
нормальном атмосферном давлении является кварцевое стекло (стекловидное
состояние), а все остальные модификации кварца менее стабильны в ряду:
кварцевое стекло – тридимит – кристобалит – кварц.
На стабильность состояния должен указывать
не переход в кристаллическое вещество, а возвращение расплава в то структурное
состояние, которое было до его плавления.
Если в отношении переохлаждения и
вытекающей из него метастабильности стеклообразного состояния имеется в
настоящее время полное единство взглядов, то относительно того, что такое
стекло – твёрдое или жидкое тело, мнения разделились. Взгляды на стекло как
переохлаждённую жидкость рассмотрены выше. Некоторые исследователи
стеклообразного состояния полагают, что стекло – твёрдое тело, получаемое
переохлаждением жидкости.
Под твёрдым телом обычно подразумевается
вещество, которое обладает некоторой жёсткостью по отношению к сдвигу. Такое
качество стёкол известно всем из практики. По твёрдости стёкла занимают
промежуточное положение между железом и закалённой сталью и являются
значительно твёрже многих традиционно твёрдых кристаллических тел – минералов.
Представления о стекле как о жидкости,
пусть даже переохлаждённой, должны приводить к ползучести стёкол под нагрузкой.
С другой стороны известно, что стёкла являются упругими и хрупкими телами. Эти
факты явно не согласуются с утверждениями о стекле как о переохлаждённой
жидкости. Наши представления о стекле как о не переохлаждённой жидкости
приводят к пониманию стекла как твёрдого тела.
Общий характер кривых рассеяния
рентгеновских лучей и изотропия в стёклах и жидкостях не является достаточным
условием для суждения об идентичности их структуры. Выбор жидкости в качестве
модели стекла недостаточно обоснован и был возможен в связи с общностью
взглядов гипотез строения стекла и жидкости как квазикристаллических.
Жидкостная концепция строения стекла носит чисто постулативный характер и
недостаточно убедительно подтверждена экспериментально. Стремление представить
структуру стекла аналогично структуре жидкости требует знания структуры
жидкости. В основу кинетической теории жидкости Я.И.Френкелем положено
сближение жидкого состояния с твёрдым кристаллическим.
Несмотря на то, что созданы теоретические
основы строения жидкостей, нельзя считать окончательно решённым вопрос об их
структуре. В действительности структура жидкости значительно сложнее, чем
структура соответствующего ей твёрдого тела. Это происходит за счёт перехода
части атомов при нагревании в возбуждённое состояние, взаимодействие их с
остальными атомами представляет весьма сложную картину. В исследовании
стеклообразного состояния сделана ориентация на жидкостную концепцию строения
стёкол. Задача расшифровки структуры самой жидкости оказалась настолько
сложной, что моделирование стекла посредством жидкости привело к усложнению
решения вопроса.
В настоящее время геометрия расположения
атомов в жидкостях недостаточно известна. Прямое исследование структуры
жидкостей является невыполнимой для эксперимента задачей. В связи с тем, что
строение жидкости неизвестно, попытка использования жидкого состояния в
качестве модели стеклообразного состояния неправомочна. Развитие представлений
о стеклообразном состоянии из общего строения жидкости нереально. Считать, что
расплав стёкол отражает их структуру в твёрдом состоянии можно лишь в той мере,
в какой это относится к кристаллическим веществам. Конечно, твёрдое тело имеет
непосредственную генетическую связь с расплавом, из которого оно образовалось.
Но именно благодаря различиям в структуре, возникающим с ростом температуры, и
происходит плавление. Жидкость не может быть использована в качестве модели
твёрдого тела в стеклообразном состоянии. Перспективнее в качестве модели
стеклообразного состояния использовать деформированное кристаллическое твёрдое
тело.
Теоретически можно представить стекло,
которое являет собой повторяющуюся однородную стеклообразную сетку, имеющую
строение в зависимости от химического состава. Однако, незнание точного
соотношения компонентов, их загрязнённости, зависимости структуры стекла от
технологических режимов приводят к появлению неоднородностей в стекле при варке
и выработке.
Естественно, что реальные стёкла далеки от
идеальной стеклообразной структуры. В получении реальных стёкол некоторую роль
может иметь вторичное переохлаждение отдельных микроучастков структуры. Многие
стёкла имеют в своей структуре ликвационные расслоения или кристаллы.
Можно провести следующую классификацию
стёкол:
1.
стекло
2.
стекло – стекло
3.
стекло – стекло –
стекло
4.
стекло – кристалл
– кристалл
5.
стекло – стекло –
кристалл
6.
стекло – стекло –
кристалл и так далее.
Таким образом, реальные стёкла можно
рассматривать как композиционные материалы, состоящие из собственно стекла с
имеющимися в нём кристаллами различных составов и ликвационными областями, образованными
стёклами иных составов.
В связи с тем, что в природе не существует
и не может существовать идеальных стёкол, и понятие «идеального стекла»
является таким же условным, как «идеального газа», необходимо при исследовании
стёкол учитывать это обстоятельство. Мы знаем, какую положительную роль сыграло
в науке понятие «идеального газа», поэтому рассмотрение «идеального стекла»
является весьма перспективным.
Построение теории стеклообразного
состояния и развитие представлений о характерных свойствах, присущих
стеклообразному состоянию, формировалось на экспериментальном материале
реальных стёкол. Отсюда вытекают те противоречия и разноречивые доводы, которые
появляются с выходом в свет новых работ. Результаты этих работ в большинстве
случаев являются частными, и поэтому не могут служить материалом для создания
общей теории стеклообразного состояния.
Построение гипотез по стеклообразному
состоянию должно базироваться на понятии «идеального стекла». Реальные стёкла
должны рассматриваться как композиционные материалы, состоящие из различных фаз
– стекловидных и кристаллических.
Свойства, присущие стеклообразному
состоянию, и предлагаемая теория строения стекла рассмотрены с позиций понятия
«идеальное стекло».
При построении теории стеклообразного
состояния принимались следующие критерии:
1.
Стекло – не
переохлаждённое состояние.
2.
Стекло –
стабильное состояние.
3.
Стекло – твёрдое
тело.
4.
Жидкостная
концепция не применима к описанию стёкол.
5.
В основу теории
стеклообразного состояния положено понятие «идеального стекла».
14. ТЕОРИЯ СТЕКЛООБРАЗНОГО СОСТОЯНИЯ И
СТРОЕНИЯ СТЕКЛА
Какое же положение занимает стекло в
системе всех материалов? Рассмотрим однокомпонентные стёкла SiO2
(кварцевое), B2O3
(боратное), P2O5 (фосфатное).
Любому состоянию вещества должны
соответствовать определённые условия (или наоборот). Такими условиями являются
температура, давление и гравитационное поле. Не говоря уже о гравитационном
поле, в исследовании стёкол не учитывается давление, что приводит к потере
важной информации. А ведь в обычных условиях получить однокомпонентное
фосфатное стекло не удаётся – оно улетучивается. Весьма летучи и
однокомпонентные боратные стёкла.
Каким образом может кристаллический кварц
перейти в кварцевое стекло? Конечно, причиной является не переохлаждение, а
переход в состояние структуры, соответствующей определённым температуре и
давлению. Кварцевое стекло сколько угодно долго может сохранять своё состояние.
При плавлении кварца происходят изменения в структуре, и плотность изменяется с
2,65 г/см3 у кварца до 2,21 г/см3 у кварцевого стекла.
Как раз эти изменения и приводят к стеклообразному состоянию кварца.
Итак, стекло – не переохлаждённая
жидкость, а вполне естественная самостоятельная стеклообразная структура,
необходимое объективное состояние вещества, проявляющееся уже в расплавах.
Агрегатное состояние вещества
определяется, прежде всего, внутренним строением. Существуют газообразное,
жидкое и твёрдое агрегатные состояния вещества. По существующим представлениям
твёрдое тело может быть кристаллическим и аморфным. В кристаллических телах
атомы расположены по строго заданным направлениям и на определённых
расстояниях. Основным признаком кристаллов является наличие резко выраженной
температурой точки плавления. Кристаллы имеют дальний порядок.
Слово «аморфный» означает «лишённый
формы». Аморфные тела противопоставляются кристаллам, представителем аморфных
тел считается обычно стекло. Иными словами, твёрдые тела, у которых отсутствует
дальний порядок, называют аморфными. При нагревании аморфные твёрдые тела
постепенно переходят в жидкости.
Стеклообразование происходит при таком
наборе атомов, когда их заряды при температуре плавления и давлении в 1
атмосферу образуют именно стеклообразную структуру. Для однокомпонентных
кварцевых стёкол переход из кристаллического состояния можно считать изоморфным
состоянием кварца – стеклообразным. Для многокомпонентных стёкол стеклообразное
состояние является формой существования материи.
Стекло – это такое сочетание или
искусственная смесь анионов и катионов, которая при расплавлении не может
создать кристаллическую структуру, атомы вынуждены образовывать то соседство,
которое возможно, и образуют наиболее стабильную в естественных земных условиях
стеклообразную структуру, характеризующуюся различными по силе химическими
связями, определяющими природу стеклообразного состояния.
Аморфного состояния с присущими ему
неестественными свойствами бесформенности в природе просто не существует. Любое
твёрдое тело с любой структурой – это единственно возможная ситуация структуры
в данных условиях. Аморфность же предполагает из одного и того же расплава при
одних и тех же условиях получать различные конечные продукты.
Стеклообразное состояние, наряду с
кристаллическим, является формой существования твёрдых тел. При этом
стеклообразное состояние – наиболее общая форма существования твёрдых тел.
Кристаллическое состояние является частным случаем стеклообразного. Это
вытекает из теории стеклообразного состояния в случае, если положим, что
количество дискретных уровней равно 1, т.е. сила всех связей в гипотетическом
твёрдом теле будет одинакова.
Утверждение о стеклообразном состоянии как
наиболее общей форме твёрдых тел соответствует действительности даже по числу
твёрдых тел, находящихся в твёрдом состоянии, и по разнообразию их структуры.
Известно 230 пространственных групп симметрии Фёдорова – возможных способов
построения кристаллической решётки. В настоящее время известно всего лишь около
2000 различных минералов, из которых только 250-300 широко распространены и
имеют практическое значение.
Количество возможных составов стёкол
практически бесконечно велико. Учитывая количество химических элементов для
введения в состав стекла, количество компонентов в системе и соотношение этих
компонентов, можно говорить о безграничности возможных вариантов существования
твёрдых тел в стеклообразном состоянии. Уже к настоящему времени количество
синтезированных стёкол велико. В связи с разнообразием состава и свойств стёкла
находят всё новые и новые области технического применения, где другие материалы
просто бессильны. Учитывая бесконечность возможных составов стекла можно
говорить о стеклообразном состоянии как о наиболее общей форме существования
твёрдых тел.
В настоящее время термин «стеклообразное
состояние» широко распространён. Под таким заголовком вышло несколько сборников
Всесоюзных совещаний по строению стекла. Однако, стеклообразное состояние
означало метастабильную переохлаждённую жидкость с аморфной структурой. Термин
«стеклообразное состояние» следует понимать, как и термин «кристаллическое
состояние», как формы существования твёрдого тела. При этом наиболее
распространённым по массе в природе в литосфере Земли является кристаллическое
состояние, а по возможному разнообразию структур – стеклообразное.
Вещества, которые в настоящее время
считаются аморфными, следует отнести к классу полиморфных кристаллических
веществ с неопределённым составом кристаллов, в которых существует целый ряд химических
связей, различных по силе.
Стекло благодаря определённому химическому
составу имеет только ему присущее строение. Входящие в состав стекла атомы
строят стеклообразную решётку только на принципах химической связи. Если набор
атомов такой, что по принципу образования системы с наименьшим внутренним
запасом энергии атомы не могут её создать, происходит расслоение структуры.
Внутренними силами, способствующими этому явлению в расплавах, являются
равнодействующие сил взаимодействия атомов, обеспечивающие расстановку с
минимальной потенциальной энергией.
Таким образом, из теории стеклообразного
состояния вытекает представление о микронеоднородности реальных стёкол. При
этом возможны случаи, когда микрогруппировки имеют состав, способный закристаллизоваться.
Образуются микрокристаллы или же эти микрогруппировки образуют стекло,
отличающееся от основной матрицы по химическому составу, т.е. происходит
ликвационный распад.
В реальных стёклах переохлаждение может
иметь некоторую роль. Переохлаждённые участки можно считать дефектами
стеклообразной структуры. Возможно их самопроизвольное расстекловывание или же
кристаллизация при термообработке со скоростью охлаждения меньшей, чем при
получении стекла.
Переохлаждение наиболее вероятно в сложных
стёклах. Так как стеклообразное состояние определяется давлением и
температурой, то в зависимости от скорости охлаждения некоторые микрообласти
расплава могут или переохладиться в стекло, или закристаллизоваться.
Кристаллизация происходит при скоростях охлаждения, соизмеримых со скоростью
диффузии, обеспечивающей доставку материала для образования кристаллической
фазы. Поэтому при большой скорости охлаждения расплавов можно получить стёкла,
которые кристаллизуются при термообработке в связи с неизмеримостью скорости
диффузии и охлаждения. Такие стёкла при термообработке изменяют свою структуру
для обеспечения равновесного состояния.
Мнение о главенствующей роли
переохлаждения, возможно, так широко распространено и общепринято в связи с тем,
что для получения реальных стёкол (особенно не промышленных, а синтезируемых
исследователями), скорость охлаждения имеет решающее значение.
Итак, микронеоднородность является
характерным признаком реальных стёкол, степень неоднородности может в них
широко варьироваться вплоть до полной однородности структуры. В виде
неоднородностей в стёклах присутствуют кристаллы, ликвационные области и их
сочетания. Реальные стёкла в этой связи являются композиционными материалами,
что следует иметь в виду при исследовании их физико-химических свойств.
Исходя из вышесказанного, исследование
зависимости свойство – состав является некорректным, и результаты многих
экспериментальных работ не могут быть признаны достоверными. Следует
исследовать зависимость свойств от микроструктуры с учётом состава микрофаз, а
также композиционного строения стёкол. В структуре стекла существует не
непрерывны спектр связей по их силе, а дискретный ряд связей. Структура стекла
при нагревании претерпевает изменения по местонахождению атомов относительно
друг друга.
15. ВЫВОДЫ
1.
Стеклообразная
структура образуется уже в расплаве, благодаря чему расплав приобретает высокую
вязкость.
2.
В расплаве стекла
имеется целый ряд установившихся жёстких химических связей, поэтому изменения
температуры приводят к изменению вязкости расплава за счёт разрыва или
восстановления химических связей.
3.
В стёклах
существует дискретный спектр связей по их силе, образующий ряд уровней. В
составе стекла дискретных уровней может быть любое количество, причём,
периодичность их и количество одинаковых связей в одном уровне могут быть
разными.
4.
При охлаждении
стеклообразного расплава восстанавливаются химические связи определённого
дискретного уровня – происходит процесс структурообразования.
5.
Во время
структурообразования снижение температуры непропорционально времени – на
диаграмме образуются площадки для каждого уровня прочности химических связей.
6.
Площадки на
диаграмме время – температура представляют линии ликвидуса, для каждой
стеклообразной системы количество линий ликвидуса соответствует числу
дискретных уровней сил связей.
7.
В частном случае,
когда набор связей в системе имеет постепенный непрерывный ряд и дискретность
пропадает, предлагаемая модель стеклообразного состояния описывает современное
общепринятое представление о структуре стекла.
8.
Стекло –
структура, состоящая из такого набора атомов, который не может составить
упорядоченного кристаллического соединения в силу существующего распределения
зарядов.
9.
Ионы в структуре
стекла могут располагаться только в узлах решётки, располагаться в междоузлиях
ионы не могут.
10. Любое перемещение иона в структуре стекла ведёт к
немедленной реакции системы, которая постоянно находится в динамическом
равновесии.
11. Силой, удерживающей стекло в едином блоке, является
коллективная химическая связь и силы неуравновешивания электрического заряда в
каждом элементарном объёме.
12. Различия по силе химической связи в твёрдом теле
определяют природу стеклообразного состояния.
13. Структура стёкол не случайна, а имеет закономерное
построение, о чём свидетельствует воспроизводимость физико-химических свойств.
14. Стабильность стеклообразной системы определяется её
устойчивостью, степень устойчивости структуры может быть разной.
15. Система с очень низкой устойчивостью может
переохладиться и представляет частный случай современных представлений о
стёклах как переохлаждённых жидкостях.
16. Наличие ликвации и микронеоднородностей в структуре
реальных стёкол свидетельствует о закономерности в построении стеклообразных
структур.
17. В стекле существует статистическая упорядоченность, о
чём свидетельствует идентичность свойств в микрообъёмах.
18. Стёкла имеют приведенный дальний порядок,
предполагающий трансляцию элемента структуры на некоторое расстояние с
одновременным её поворотом.
19. Стекло не имеет ближнего порядка, что является его
главным отличием от кристалла.
20. При нагревании стекла разрываются самые слабые связи,
и система немедленно реагирует на это путём изменения местонахождения остальных
ионов – система изменяется, деформируется для сохранения устойчивости.
21. Стекло – это упорядоченная система с переменной
структурой, которая при повышении температуры изменяет не только кинетическую
энергию ионов, а также их относительное расположение.
22. При наличии разорванных структурных связей в стекле
оно представляет гетерогенную систему твёрдое тело – жидкость.
23. Величина вязкости нагретых стёкол зависит от полноты
разрыва дискретного спектра связей.
24. Кристаллическое состояние вещества не всегда является
самым стабильным, стекло всегда стабильно.
25. Однокомпонентные стёкла представляют изоморфное
состояние вещества, для многокомпонентных стёкол стеклообразное состояние
является формой существования материи.
26. Стекло – такое сочетание или искусственная смесь
атомов, вынужденных при расплавлении образовывать ту структуру, которая
соответствует их зарядам и образует наиболее стабильную в естественных земных
условиях стеклообразную структуру, характеризующуюся различными по силе
химическими связями, определяющими природу стеклообразного состояния.
27. Аморфного состояния вещества в природе не существует,
любое твёрдое тело с любой структурой – единственно возможная ситуация
структуры в данных условиях.
28. Стеклообразное и кристаллическое состояния являются
формами существования твёрдых тел.
29. Стеклообразное состояние – наиболее общая форма
существования твёрдых тел, кристаллическое состояние является частным случаем
стеклообразного.
30. Из теории стеклообразного состояния вытекает
представление о микронеоднородности реальных стёкол. Степень неоднородности
структуры может широко варьироваться вплоть до полной её однородности.
31. В связи с наличием микронеоднородностей – кристаллов и
ликвационных областей, реальные стёкла следует рассматривать как композиционные
материалы.
32. Исследование зависимости свойств от состава –
некорректная постановка эксперимента. Следует исследовать свойства в
зависимости от структуры, учитывая композиционное строение стекла.
33. Вещества, которые в настоящее время считаются
аморфными, следует отнести к классу полиморфных кристаллических веществ, в
которых существует целый ряд химических связей, различных по силе.
15. ВЛИЯНИЕ ТЕОРИИ
СТРОЕНИЯ СТЕКЛА НА ДРУГИЕ НАУКИ
Выше указывалось, что кварц,
представленный широким классом минералов, является нестабильным. Наиболее
стабильным состоянием кварца является стеклообразное. Это относится не только к
кварцу, а также к базальту. Базальт представляет собой смесь минералов
плагиоклаза и пироксена. Из базальтов получают стекло в промышленном масштабе.
То обстоятельство, что в существующих условиях ряд минералов после расплавления
не выкристаллизовывается повторно, а образует стёкла, является очень важным
фактом. При этом следует обратить внимание на то, что природных стёкол, имеющих
такой же возраст и распространение, как минералы, не существует.
По предлагаемой модели наиболее стабильным
состоянием не обязательно должно быть кристаллическое вещество, им может быть
также стекло.
Если бы образование Земли из
расплавленного состояния происходило в существующих условиях, большую часть
материков покрывали бы массивы стёкол. То, что стёкол вообще в природе нет, а
кора Земли состоит из кристаллических пород, представляет большой интерес.
Кристаллическое вещество земной коры является элементом памяти тех условий, в
которых оно происходило. В этой связи предлагаемая теория может дать
представления об условиях образования Земли. Отсюда может быть пролит свет на
происхождение Земли, и открываются возможности построения гипотез как о самой
Земле и её нынешнем виде, так и о происхождении жизни на Земле.
Намечается новый стык наук – физики
твёрдого тела и геофизики. То, что теория стеклообразного состояния приводит к
постановке таких вопросов, ещё раз показывает важность проблемы стеклообразного
состояния.
Отсутствие приемлемой теории строения
стекла и стеклообразного состояния не позволяет объяснять экспериментальные
данные по многим физико-химическим свойствам стёкол. В связи с этим для
объяснения каждого свойства и явления в стеклообразном состоянии строятся свои
теории, чрезвычайно противоречащие даже для объяснения одного и того же факта.
На основе предлагаемой теории
стеклообразного состояния и строения стекла открывается возможность объяснения
с единых позиций всех явлений в стеклообразном состоянии и физико-химических
свойств стёкол. Это следующие явления и свойства: стеклообразование, вязкость,
ликвация, кристаллизация, микроструктура стёкол, диффузия, дефекты в структуре,
плотность, электрические, тепловые, химические, механические, оптические и
поверхностные свойства.
16. ОБЩИЕ ВЫВОДЫ
1. Существующие гипотезы стеклообразного
состояния не способны объяснить экспериментальных результатов.
2. Предложена теория стеклообразного
состояния, основанная на представлениях о стекле как стабильном твёрдом теле.
Фазовый переход расплав – твёрдое тело осуществляется за счёт
структурообразования при различных температурах, что на диаграмме температура –
время выражается наличием целого ряда линий ликвидуса.
3.Стекло – такое сочетание или
искусственная смесь атомов, образующих закономерно построенную стеклообразную
структуру в соответствии с их зарядами, наиболее стабильную в естественных
земных условиях, характеризующуюся дискретным набором различных по силе
химических связей, определяющих природу стеклообразного состояния, и
представляющее упорядоченную систему, обладающее переменной структурой и
приведенным дальним порядком.
4. Стеклообразное состояние является
наиболее общей формой существования материи в виде твёрдых тел, кристаллическое
состояние – частный случай стеклообразного.
5.
Предлагаемая теория объясняет ряд признаков, физико-химических свойств и
явлений в стеклообразном состоянии. На основе теории можно с единых позиций
объяснить экспериментальные данные по исследованию всех физико-химических
свойств стёкол.
6. Предлагаемая модель даёт возможность
подойти к вопросам объяснения образования Земли. Возможно создание нового стыка
наук – физики твёрдого тела (стеклообразного) и геофизики.
7. Аморфного состояния вещества в природе
не существует, любое твёрдое тело с любой структурой – единственно возможная
ситуация структуры в данных условиях. Вещества, которые в настоящее время
считаются аморфными, следует отнести к классу полиморфных кристаллических
веществ, в которых существует целый ряд химических связей, различных по силе.
ЛИТЕРАТУРА
1. Стеклообразное состояние,
391. Наука, Л., 1971.
2. Г.М.Бартенев. Строение и
механические свойства неорганических стёкол, 5. Стройиздат, М., 1966.
3. А.И.Болутенко. Научные гипотезы. Физика стекла, ст.
10, 1978.
4. А.И.Болутенко. Научные гипотезы. Физика стекла, гип.
1, 1977.
5. А.Н.Бардин. Технология
оптического стекла, 68. Высшая школа, М., 1963.
6. А.И.Болутенко. Научные гипотезы. Физика стекла, ст.
11, 1978.
7. А.И.Болутенко. Научные гипотезы. Физика стекла, ст.
9, 1976.
8. А.И.Болутенко. Научные гипотезы. Физика стекла, ст.
12, 1978.
9. O.S.Narayanaswamy. J. Amer. Ceram. Soc., 54, № 10, 491, 1971.
10. П.П.Кобеко. Аморфные вещества, 5. Изд. АН СССР, М., 1952.
11. В.К.Леко. Ж. неорг.
матер., 3, № 7, 1224, 1967.
12. О.В.Мазурин, А.С.Тотеш,
М.В.Стрельцина, Т.П.Швайко-Швайковская. Тепловое расширение стекла, 61. Наука,
Л., 1969.
13. Б.Ф.Ормонт. Структуры
неорганических веществ, 132. ГИТТЛ, М.-Л., 1950.
14. Я.И.Френкель.
Кинетическая теория жидкостей, 20. Изд. АН СССР, М.-Л., 1945.
15. Р.Пайерлс. Квантовая
теория твёрдых тел, 17. Изд. иностр. лит., М., 1956.
16. А.С.Поваренных. Кристаллохимическая
классификация минеральных видов, 34. Наукова думка, Киев, 1966.
17. В.С.Постников. В сб.:
Релаксационные явления в твёрдых телах, 11. Металлургия, М., 1968.
18. В.А.Флоринская,
Р.С.Печёнкина. В сб.: Строение стекла, 70. Изд. АН СССР, М., 1955.
19. Н.Мотт, Э.Дэвис.
Электронные процессы в некристаллических веществах, 204. Мир, 1974.
20. Инфракрасные спектры
неорганических стёкол и кристаллов, 205. Под ред. А.Г.Власова и В.А.Флоринской.
Химия, Л., 1972.
21. Ч.Уэрт, Р.Томсон. Физика
твёрдого тела, 103. Мир, М., 1969.
22. Л.Л.Мухина,
А.А.Аскадский, Г.М.Бартенев, И.В.Разумовская, Г.Л.Слонимский. Высокомол. соед.,
А15, №3, 641, 1973.
23. Г.М.Бартенев.
Сверхпрочные и высокопрочные неорганические стёкла, 40. Стройиздат, М., 1974.
24. Н.Н.Сирота. В сб.:
Химическая связь в полупроводниках и твёрдых телах, 12. Наука и техника, Минск,
1965.
25. В.И.Лебедев.
Ионно-атомные радиусы и их значение для геохимии и химии, 32. Изд. Ленингр.
ун-та, 1969.
26. Л.А.Брыскина, В.А.Жданов.
В сб.: Химическая связь в полупроводниках и твёрдых телах, 28. Наука и техника,
Минск, 1965.
27. Т.А.Сидоров. Стекло и
керамика, № 11, 43, 1960.
28. Н.В.Соломин. Стекло и
керамика, № 6, 12. 1964.
29. Н.М.Павлушкин. Основы
технологии ситаллов, 19. Стройиздат, М., 1970.
30. Н.А.Торопов, Л.Н.Булак.
Кристаллография и минералогия, 67. Стройиздат, Л., 1972.
31. S.P.Jones. Phys. and Chem. Glasses, 2, № 2, 55, 1961.
32. А.И.Августиник, И.С.Цуранова. Ж. физ. химии, 36, № 3, 608,
1962.
33. Я.С.Бобович. Оптика и
спектроскопия, 15, 5, 647, 1963.
34. М.А.Безбородов. Синтез и
строение силикатных стёкол, 22. Наука и техника, Минск, 1968.
35. Н.М.Бобкова,
О.Г.Городецкая. Ж. неорг. матер., 9, № 4, 677, 1973.
36. W.A.Weyl. Sprehsaal, 93, №
6, 128, 1960.
37. Н.В.Петровых, Э.Л.Нагаев.
Вопр. радиоэлетр., 4, 1, 47, 1962.
38. В.П.Прянишников. Система
кремнезёма, 56. Стройиздат, Л., 1971.
39. П.П.Кобеко. В сб.:
Строение стекла, 296. Изд. АН СССР, М., 1955.
40. О.А.Есин. В сб.: Вопросы
шлакопереработки, 81. Челябинск, 1960.
41. И.М.Вассерман,
М.П.Никитина. В сб.: Кварцевое стекло, 64. М., 1972.
42. Ю.Р.Закис. Физика и химия
стеклообразующих систем, 6. Уч. зап. Латв. гос. ун-та, 182, 1, Рига, 1973.
43. Н.И.Шишкин. ФТТ, 2, 2,
350, 1960.
44. Г.К.Демишев. Стекло. Тр.
ин-та стекла, № 2 (127), 40, 1965.
45. А.А.Аппен. ЖПХ, 27, 2,
121, 1954.
46. В.В.Варгин, Т.В.Зарубина,
С.А.Степанов. ЖПХ, 45, № 3, 654, 1972.
47. Л.И.Дёмкина. В сб.:
Строение стекла, 107. Изд. АН СССР, М., 1955.
48. Л.Г.Мельниченко. В сб.:
Строение стекла, 126. Изд. АН СССР, М., 1955.
49. Г.Б.Бокий. В сб.:
Строение стекла, 350. Изд. АН СССР, М., 1955.
50. Н.А Шишаков. Вопросы
структуры силикатных стёкол, 5. Изд. АН СССР, М., 1954.
51. K.Fajans, S.W.Barber. J. Amer. Chem. Soc., 74, 2761, 1952.
52. В.В.Тарасов.
Кристаллография, 2, 489, 1957.
53. О.К.Ботвинкин. Введение в
физическую химию силикатов, 90. Гизлегпром, М.-Л., 1938.
54. А.А.Лебедев. Тр. гос.
оптического ин-та, 2, 10, 76, 1921.
55. А.А.Лебедев. В сб.:
Строение стекла, 360. Изд. АН СССР, М., 1955.
56. А.А.Лебедев. В сб.:
Строение стекла, 84. Гос. химико-технич. изд., М.-Л., 1933.
57. В.В.Богатырёва,
М.С.Гомельский, Р.Н.Шакирова. Опт.-мех. пром., № 11, 48, 1970.
58. А.И.Стожаров. В сб.:
Строение стекла, 120. Изд. АН СССР, М., 1955.
59. Н.А.Тудоровская. В сб.:
Строение стекла, 190. Изд. АН СССР, М., 1955.
60. З.У.Борисова. Ж.физ.
химии, 41, № 8, 1942, 1967.
61. Г.В.Куколев. Химия
кремния и физическая химия силикатов, 94. Высшая школа, М., 1966.
62. А.Бейзер. Основные
представления современной физики, 265. Атомиздат, М., 1973.
63. Н.В.Белов. В сб.: Строение
стекла, 344. Изд. АН СССР, М., 1955.
64. Г.Роусон. Неорганические
стеклообразующие системы, 14. Мир, М., 1970.
65. Р.Л.Мюллер. Химия
твёрдого тела, 9. Изд. Ленингр. ун-та, 1965.
66. А.М.Андриеш, В,В.Соболев,
Ю.В.Попов. В сб.: Химическая связь в полупроводниках, 339. Наука и техника,
Минск, 1969.
67. B.Eckstein. Kolloid-Z. und Z. Polymeri, 233, № 1-2, 845, 1969.
68. R.S.Prasool, J.O.Isard. Phys. and Chem. Glasses, 8. № 6, 218, 1967.
69. Ю.Ф.Макаров, Н.Б.Решетняк. ФТТ, 14, 1, 47, 1972.
70. Е.В.Смирнова. Ж. неорг.
матер., 4, № 7, 1124, 1968.
71. Е.Ф.Гросс, В.А.Колесова.
В сб.: Строение стекла, 56. Изд. АН СССР, М., 1955.
72. В.А.Колесова. Неорган.
матер., 7, № 2, 348, 1971.
73. И.И.Тычина, В.Г.Федотов,
И.М.Иванова. В сб.: Химическая связь в полупроводниках, 334. Наука и техника,
Минск, 1965.
74. M.F.Mydlar, N.J.Kreidl, J.K.Hendren, G.T.Clayton. Phys. and Chem.
Glasses, 11, № 6, 196, 1970.
75. К.П.Дутова. Неорг.
матер., 4, № 8, 1296, 1968.
76. Н.М.Павлушкин,
Л.С.Егорова. Стеклообразные системы и новые стёкла на их основе, 208. ВНИИЭСМ,
М., 1971.
77. А.А.Аппен. Химия стекла,
338. Химия, Л., 1970.
78. Д.М.Юдин, А.В.Шендрик,
М.Л.Петровская, Г.П.Николина. ФТТ, 15, 9, 2636, 1973.
79. В.Н.Морозов.
Стеклообразные системы и новые стёкла на их основе, 44. ВНИИЭСМ, М., 1971.
80. А.М.Андриеш, В.В.Соболев.
В сб.: Химическая связь в полупроводниках и термодинамика, 212. Наука и
техника, Минск, 1966.
81. Ю.А.Шмидт. В сб.,
Стеклообразное состояние, 310. Изд. АН СССР, М.-Л., 1960.
82. В.А.Флоринская. Сборник
статей, посвящённый 80-летию со дня рождения академика А.А.Лебедева, 518.
Машиностроение, Л., 1973.
83. А.А.Лебедев. Труды гос.
оптического ин-та, 2, № 10, 1, 1921.
84. О.В.Мазурин.
Электрические свойства стекла, 47. Тр. Ленингр. технол. ин-та, вып.62, Л.,
1962.
85. П.П.Кобеко. В сб.:
Строение стекла, 19. Изд. АН СССР, М., 1955.
86. Инфракрасные спектры
щелочных силикатов. Под. ред. А.Г.Власова и В.А.Флоринской, 339. Химия, М.,
1970.
87. Н.С.Андреев, Д.А.Гоганов,
Е.А.Порай-Кошиц, Ю.Г.Соколов. В сб.: Стеклообразное состояние, вып. 1, 46. Изд.
АН СССР, М.-Л., 1963.
88. H.D.Blair, M.E.Milberg. J. Amer. Ceram. Soc., 57, № 6, 257, 1974.
21.05.1979
Публикация 23.02.2012